
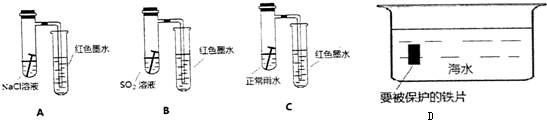
分析 (1)强酸性条件下,铁发生析氢腐蚀,中性或弱酸性条件下,铁发生吸氧腐蚀,A装置溶液呈中性,铁发生吸氧腐蚀,正极上氧气得电子发生还原反应;
(2)作原电池正极或电解池阴极的金属被保护;
(3)试剂1起溶解作用,盐酸、稀硫酸均可,但试剂2不能用盐酸,易被高锰酸钾氧化,影响实验测定,则该实验中的试剂2与甲同学设计的实验中的试剂1都可以是稀硫酸;
(4)KMnO4溶液用酸式滴定管盛放,滴定时左手旋转活塞,滴入样品溶液中,当滴入最后一滴高锰酸钾溶液时,溶液变成紫红色,且30s保持不变,则到达滴定终点;
(5)设含亚铁离子为xmol,则
5Fe2++8H++MnO4-═5Fe3++Mn2++4H2O
5 1
x 0.02mol×12×0.001L,
x=1.2×10-3mol,
1000mL溶液,取出20.00mL,则药品中含n(Fe2+)=0.0200mol/L×12.00×10-3L×5×$\frac{1000mL}{20mL}$=0.0600mol,
m(Fe2+)=0.0600mol×56g/mol=3.36g,
含“铁”量为:$\frac{3.36g}{10g}$×100%=33.6%,
依据说明书中的部分内容可知该药品含Fe2+33%~36%,判断该药品是否合格.
解答 解:(1)强酸性条件下,铁发生析氢腐蚀,中性或弱酸性条件下,铁发生吸氧腐蚀,A装置溶液呈中性,铁发生吸氧腐蚀,B、C溶液呈酸性,铁发生析氢腐蚀,但B中酸性较强,所以铁发生腐蚀严重,发生吸氧腐蚀时左边试管中压强减小,右边导管中红墨水上升,B、C右边导管中红墨水下降,且B下降比C多,所以右侧导管中红墨水高度:A>C>B;
A中铁发生吸氧腐蚀,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,
故答案为:A>C>B;O2+4e-+2H2O=4OH-;
(2)作原电池正极或电解池阴极的金属被保护,所以Fe可以连接比铁活泼的金属或连接电源负极,即牺性阳极的阴极保护法或外加电流的阴极保护法,答:可采用牺性阳极的阴极保护法或外加电流的阴极保护法.
(3)试剂1起溶解作用,盐酸、稀硫酸均可,但试剂2不能用盐酸,易被高锰酸钾氧化,影响实验测定,则该实验中的试剂2与甲同学设计的实验中的试剂1都可以是稀硫酸,故答案为:C;
(4)KMnO4溶液用酸式滴定管盛放,滴定时左手旋转活塞,滴入样品溶液中,当滴入最后一滴高锰酸钾溶液时,溶液变成紫红色,且30s保持不变,则到达滴定终点;
故答案为:当滴入最后一滴高锰酸钾溶液时,溶液变成紫红色,且30s保持不变,则到达滴定终点;
(5)设含亚铁离子为xmol,则
5Fe2++8H++MnO4-═5Fe3++Mn2++4H2O
5 1
x 0.02mol×12×0.001L,
x=1.2×10-3mol,
1000mL溶液,取出20.00mL,则药品中含n(Fe2+)=0.0200mol/L×12.00×10-3L×5×$\frac{1000mL}{20mL}$=0.0600mol,
m(Fe2+)=0.0600mol×56g/mol=3.36g,
含“铁”量为:$\frac{3.36g}{10g}$×100%=33.6%,
说明书中的部分内容可知该药品含Fe2+33%~36%,则该药品含“铁”量合格,
故答案为:合格.
点评 本题考查金属腐蚀与防护,明确原电池原理和电解池原理即可解答,知道钢铁发生析氢腐蚀和吸氧腐蚀的条件、区别,知道防止金属被腐蚀的方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
 实验室用乙醇、浓磷酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H3PO4(浓)+NaH2PO4+HBr、CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O
实验室用乙醇、浓磷酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H3PO4(浓)+NaH2PO4+HBr、CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色 液体 | 无色 液体 | 深红棕色 液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题




查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是一个基本物理量,表示物质所含粒子的多少 | |
| B. | 1mol氢中含有2mol氢原子和2mol电子 | |
| C. | 1molH2O的质量等于NA个H2O质量的总和(NA表示阿伏加德罗常数) | |
| D. | 12g碳所含的原子数就是阿伏加德罗常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO).c(S{O}_{3})}{c(N{O}_{2}).c(S{O}_{2})}$的值及SO2转化率不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com