
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色” 消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备C1O2的流程如下:
(1)C1O2中所有原子________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用________
A.饱和食盐水B.碱石灰 C.浓硫酸D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是________(填选项字母)。
A.二氧化氯可广泛用于工业和饮用水处理
B.二氧化氯应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和检测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,化学方程式为________。此法缺点主要是产率低、产品难以分离,还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式为________此法相比欧洲方法的优点是________。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学方程式为________。此法提高了生产及储存、运输的安全性,原因是_________
(1) 不是 C
(2)A、B、C、D
(3)2NaClO3+4HCl(浓)= 2NaCl+Cl2↑+2ClO2↑+2H2O
(4)2NaClO2+Cl2=2NaCl+2ClO2 安全性好,没有产生毒副产品
(5)H2C2O4+2NaClO3+H2SO4 = Na2SO4+2CO2↑+2ClO2↑+2H2O
反应过程中生成的二氧化碳起到稀释作用
解析试题分析:(1)ClO2分子中有3原子5电子的大π键,因此不是每个原子都满足8电子。气体B可使石蕊试液显蓝色,说明B气体显碱性,根据气体来源,则B为氨气,除去氨气可用浓硫酸。
(2)ClO2可用于自来水消毒,A正确;ClO2有杀菌、消毒的功能,因此可延长食品贮藏期,B正确;稳定性二氧化氯是为推广二氧化氯而开发,因此可扩大二氧化氯的应用范围,C正确;二氧化氯有毒、不稳定、易爆炸,因此在密闭空间使用时要有检测和警报装置,D正确。
(3)根据氧化还原反应原理及题中产品污染环境,可知在生成ClO2的同时,还有Cl2生成。
(4)NaClO2中Cl的化合价升高生成ClO2,则Cl2中的Cl化合价降低,生成Cl-。此法不产生Cl2,不污染环境。
(5)氯酸钠被还原,则草酸被氧化,产物为CO2,根据氧化还原反应得失电子守恒及原子守恒可写出方程式。该反应生成的CO2可稀释ClO2气体,增加了ClO2运输、使用的安全性。
考点:考查工艺流程分析,化学方程式书写,元素化合物等。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:填空题
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)反应I的化学方程式为: 。
(3)“灼烧”时发生反应的化学方程式: 。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(5)副产品X的化学式是 。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为 。检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、 Mg2+、 Ca2+、Cu2+等)制备氯化锌的一种流程如下:
(1)在反应3前要将菱锌矿研磨,其目的是_______________________________
(2)反应4将Fe2+氧化为Fe3+,该反应的离子方程式为______________________
(3)加入氧化锌调节pH=4.5,反应5的离子方程式为________________________
(4)锌粉不在反应4之前加的原因是____________________________________
(5)若用石墨作电极电解滤液Y,则可以得到参与本流程反应的物质有_________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业。工业上利用TiO2制备金属钛的流程如下。
已知:I.
Ti(s)+O2(g)=TiO2(s) △H=-946 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1
Ti(s)+2Cl2(g)=TiCl4(g) △H=-815 kJ·mol-1
II.某温度下各物质的沸点如下:
| 物质 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
| 沸点/℃ | 136 | 310 | 56.5 | 180 |
 TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
 TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因
TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成为是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下: 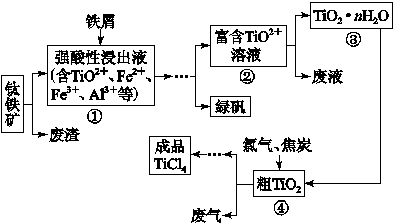
回答下列问题:
往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可以制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4的,可采用 方法。
| | TiCl4 | SiCl4 |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgO?B2O3?H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:
已知:H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g。Fe3 +、Al3+、Fe2 +和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、5.2、9.7和12.4。
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器溢出,故应分批加入稀硫酸。该反应的化学方程式为 。
(2)“浸出液”显酸性,含H3BO3和Mg2+、SO42-,还含有Fe3 +、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是 。H2O2的作用是 (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是 。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4?H2O,应采取的措施是将“母液”蒸发浓缩, 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(6分)(2012?重庆)化学工业是国民经济的支柱产业.下列生产过程中不涉及化学变化的是( )
| A.氮肥厂用氢气和氮气合成氨 | B.钢铁厂用热还原法冶炼铁 |
| C.硫酸厂用接触法生产硫酸 | D.炼油厂用分馏法生产汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于化工生产的叙述中,符合目前工业生产实际的是
| A.石油工业中,采用干馏的方法把石油分成不同沸点范围的产品 |
| B.硝酸工业中,为了加快氨氧化的速率,通常使用铁触媒作催化剂 |
| C.纯碱工业中,氨碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率 |
| D.合成氨工业中,采用高压条件,增大合成氨反应的平衡常数,增大原料转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关生铁炼钢的叙述错误的是( )。
| A.添加必要的元素,改善钢材的组织结构和性能 |
| B.适当降低生铁中的含碳量,除去大部分硫、磷等杂质 |
| C.加入硅、锰、铝等合金元素调整成分并脱去钢水中的氧 |
| D.除去生铁中的非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com