
下图是部分短周期元素原子序数与最外层电子数之问的关系图,下列说法中正确的是
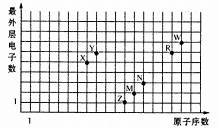
A、元素对应的离子半径:Z>M>R>W
B、简单氢化物的沸点:W>R>Y>X 层电
C、M、N、R、W的简单离子均能促进水的电离
D、Z、X、R、W的最高价氧化物对应的水化物均能与N的单质反应
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
工业上生产玻璃是以Na2CO3、CaCO3和SiO2为原料在高温下反应制得的。
(1)写出有关反应的化学方程式。
(2)如果玻璃的成分用氧化物形式表示为Na2O·CaO·6SiO2,则生产1 t这种玻璃需Na2CO3、CaCO3、SiO2各多少吨(保留3位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的两个实验装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol·L-1,工作一段时间后,测得两端导线中均通过0.02 mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )

A.产生气体的体积:①>②
B.两极上析出物质的质量:②>①
C.溶液的pH变化:①增大,②减小
D.电极反应式①中阳极:4OH-—→2H2O+O2↑+4e-;②中阴极:2H++2e-—→H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
家用不粘锅是在普通锅的内壁涂一层树脂制成,有了这层树脂,烹调时锅就不会粘食物,这层树脂主要是聚四氟乙烯。以下对聚四氟乙烯的叙述中正确的是 ( )。
A.它是一种纯净物 B.它的链节是—CF2===CF2—C.它是缩聚反应的产物 D.它的单体是CF2===CF2
查看答案和解析>>
科目:高中化学 来源: 题型:
食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏氯乙烯(PVDC)等种类。PVC被广泛地用于食品、蔬菜外包装,它对人体有潜在危害。下列有关叙述不正确的是  ( )。
( )。
A.PVC保鲜膜属于链状聚合物,在高温时易熔化,能溶于酒精
B.PVC单体可由PE的单体与氯化氢加成制得
C.鉴别PE和PVC,可把其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则是PVC;不变红, 则为PE
则为PE
D.等质量的聚乙烯和乙烯完全燃烧消耗的氧气一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
关于聚四氟乙烯的下列说法中,错误的是 ( )。
A.能够耐强酸、强碱甚至“王水”的腐蚀
B.摩擦系数小,极其光滑,可以减少与雪或水的摩擦力
C.由单体发生缩聚反应而制得的
D.耐高温又耐低温,绝缘性好,在水中也不会被浸湿或膨胀
查看答案和解析>>
科目:高中化学 来源: 题型:
有效地利用现有能源和开发新能源已受到各国的普 遍重视。改进汽油组成的办法可用来改善汽油的燃烧性能。例如,加入CH3OC(CH3)3来生产“无铅汽油”。CH3OC(CH3)3分子中必存在的原子间连接形式有 ( )。
遍重视。改进汽油组成的办法可用来改善汽油的燃烧性能。例如,加入CH3OC(CH3)3来生产“无铅汽油”。CH3OC(CH3)3分子中必存在的原子间连接形式有 ( )。
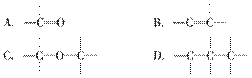
查看答案和解析>>
科目:高中化学 来源: 题型:
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
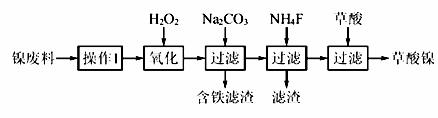
(1)操作1为 。
(2)生产过程中多次进行过滤,实验室进行过滤操作中需用到玻璃棒,下列实验操作中哪些操作中玻璃棒的作用完全相同的是 (填选项字母)。
①配制0.1mol/L的H2SO4溶液
②测定Na2CO3溶液的pH
③用KI淀粉试纸检验溶液中的氧化性离子
④加热食盐溶液制备NaCl晶体
⑤配制20%的KNO3溶液
A.①⑤ B.②③ C.④⑤ D.①④
(3)加入H2O2发生的主要反应的离子方程式为 ;加入Na2CO3溶液调pH至4.0~4.5,其目的为 ; 加入NH4F后除掉的杂质是 。
加入NH4F后除掉的杂质是 。
(4)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得Ni2O3,同时获得混合气体。草酸镍受热分解的化学方程式为 。
(5)工业上还可用电解法制取Ni2O3。用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后采用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为 。amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 。
(6)电解法制取Ni2O3的实际过程中,有时获得一种结晶水合物,已知含1molNi的该物质中含有0.5mol结晶水。取该化合物20.2g进行充分加热,获得Ni2O3固体和0.2mol水,则该结晶水合物的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com