
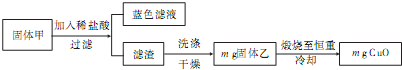
| ||
| ||
| ||
| ||
| ||
| ||
| 32m |
| 56 |
| 32m |
| 128 |
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑤ | B、①③④ |
| C、①②③④ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
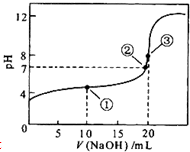 常温下,用0.1mol?L-1 NaOH溶液滴定20mL 0.1mol?L-1CH3COOH溶液的滴定曲线如图所示.下列说法正确的是( )
常温下,用0.1mol?L-1 NaOH溶液滴定20mL 0.1mol?L-1CH3COOH溶液的滴定曲线如图所示.下列说法正确的是( )| A、点①所示溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | ||
| B、点②所示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH)+c(OH-) | ||
| C、点③所示溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | ||
D、在整个滴定过程中:溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
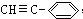 )可用合成一系列芳炔类大环化合物,其结构如下,有关叙述正确的是( )
)可用合成一系列芳炔类大环化合物,其结构如下,有关叙述正确的是( )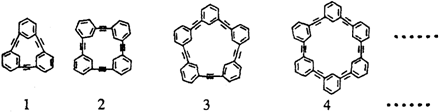
| A、上述四种物质属于苯乙炔的同系物 |
| B、第一种物质的分子式为C18H12 |
| C、它们可通过苯乙炔的加成反应获得 |
| D、该系列化合物的含碳量均相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com