
| A. | 一定大于92.0 kJ | B. | 一定等于92.0 kJ | C. | 一定小于92.0 kJ | D. | 不能确定 |
科目:高中化学 来源: 题型:选择题
| A. | 与浓氢溴酸卤代 | B. | 与浓硫酸共热消去 | ||
| C. | 铜催化下氧化 | D. | 与戊酸催化酯化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
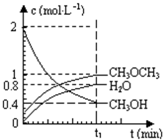 已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ•mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题:
已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=23.5kJ•mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 举行“地球一小时”熄灯活动 | B. | 露天焚烧稻草和秸秆 | ||
| C. | 夏天将空调的温度设置在26℃以上 | D. | 生活垃圾分类回收处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的Ba(OH)2与明矾[KAl(SO4)2•12H2O]加入足量水中:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| D. | 在AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
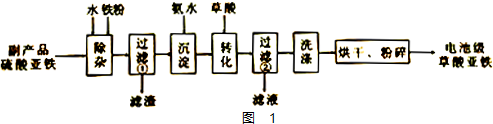
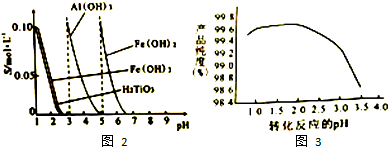
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com