
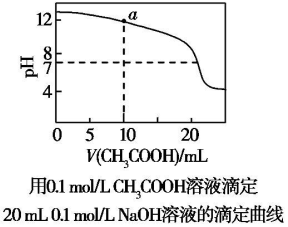
| A. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(CH3COONa)<c(Na2CO3)<c(NaOH) | |
| B. | H2A为弱酸,则0.1 mol.L-1NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| C. | 图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 上图中a点溶液:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
分析 A.电解质溶液:①Na2CO3 溶液中碳酸根离子水解显碱性,②CH3COONa 醋酸根离子水解显碱性,③NaOH氢氧化钠是强碱溶液,依据阴离子水解程度分析判断;
B.H2A为弱酸,则0.1 mol.L-1NaHA溶液中存在物料守恒,n(Na)=n(A);
C.溶液中存在电荷守恒分析判断;
D.a点是0.1mol/LCH3COOH溶液10ml滴定20ml0.1mol/LNaOH溶液,反应后得到等浓度的CH3COONa和NaOH的混合溶液.
解答 解:A.氢氧化钠是强碱,不水解,相同浓度的三种溶液氢氧化钠的pH最大,所以pH相同的三种溶液中,氢氧化钠浓度最低,已知酸性:CH3COOH>H2CO3>HCO3->CO32-,所以碳酸钠的水解程度大于碳酸氢钠,大于醋酸钠,则当三种溶液的pH相同时,其物质的量浓度由大到小的顺序是c(CH3COONa)>c(Na2CO3)>c(NaOH),故A错误;
B.H2A为弱酸,则0.1 mol.L-1NaHA溶液中存在物料守恒:c(Na+)=c(A2-)+c(HA-)+c(H2A),故B错误;
C.溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故C错误;
D.溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),物料守恒2c(CH3COO-)+2c(CH3COOH)=c(Na+),c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故D正确;
故选D.
点评 本题考查了弱电解质电离平衡、盐类水解、电解质溶液中电荷守恒和物料守恒、离子浓度大小比较等,掌握基础是解题关键,题目难度中等.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| A. | 2H2 (g)+O2(g)=2H2O(l) | B. | H2(g)+Cl2 (g)=2HCl(g) | ||
| C. | (NH4)2CO3(s)=NH4HCO3 (s)+NH3(g) | D. | Cu(s)+Cl2 (g)=CuCl2 (s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定状况下,气体摩尔体积(Y)与该气体的物质的量(X)的关系 | |
| B. | 在光照情况下,一定体积的饱和氯水的pH(Y)随时间(X)的关系 | |
| C. | 100℃,1个大气压下,按体积比1:1混合的CO2和H2O(g)混合气通过足量Na2O2粉末,固体增加的质量(Y)与混合气体积(X)的关系 | |
| D. | 向AlCl3溶液中滴加NaOH溶液至过量,生成Al(OH)3 的物质的量(Y)与消耗NaOH的物质的量(X)的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数 | |
| B. | 对于有气体参加的化学反应,若增大压强,可增大活化分子的百分数 | |
| C. | 升高温度,可以增大活化分子百分数 | |
| D. | 活化分子间的碰撞一定是有效碰撞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑥ | B. | ②③⑤ | C. | ①②③⑤ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
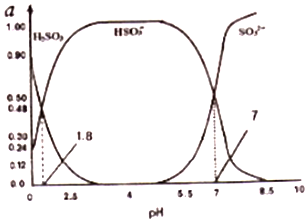
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝锂合金的硬度大于纯铝、熔点低于锂单质 | |
| B. | 改变原料的配比,可以制得性能不同的铝锂合金 | |
| C. | 铝锂合金的性质与各成分金属的性质完全相同 | |
| D. | 铝锂合金优点是密度较小、强度较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8:5 | B. | 6:5 | C. | 2:1 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
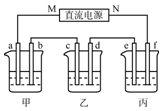 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5%的NaOH溶液、足量的CuSO4溶液和10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5%的NaOH溶液、足量的CuSO4溶液和10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com