
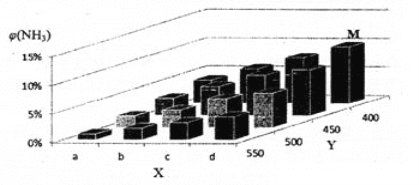
【题目】1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟哈伯合成氨的工业化生产: N2(g) +3H2(g) ![]() 2NH3(g)△H < 0 当改变某一外界条件(温度或压强)时,NH3的体积分数φ(NH3)变化趋势如下图所示。
2NH3(g)△H < 0 当改变某一外界条件(温度或压强)时,NH3的体积分数φ(NH3)变化趋势如下图所示。
(1)已知:①NH3(l) ![]() NH3(g) ΔH1 ②N2(g)+3H2(g)
NH3(g) ΔH1 ②N2(g)+3H2(g) ![]() 2NH3(l) ΔH2,则反应N2(g)+3H2(g)
2NH3(l) ΔH2,则反应N2(g)+3H2(g) ![]() 2NH3(g)的△H=________(用含△H1、△H2的代数式表示)。
2NH3(g)的△H=________(用含△H1、△H2的代数式表示)。
(2)X轴上a点的数值比b点 _____(填“大”或“小”),Y轴表示_______(填“温度”或“压强”)。
(3)将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件相关数据如下表所示:
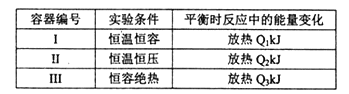
下列判断正确的是________。
A.放出热量:Ql< Q2<|△H| B.N2的转化率:I> III
C.平衡常数:II >I D.达平衡时氨气的体积分数:I>II
(4)平衡时,M点NH3的体积分数为10%。若同温同容下,再充入0.2mol N2,0.6mol H2和1.6molNH 3,重新达平衡时NH3的体积分数________ 10%(填“>”、“<”、“=”或“无法确定”)。
(5)某科研小组探究在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响.实验结果如图所示:(图中T2和T1表示温度,n表示起始时H2的物质的量)
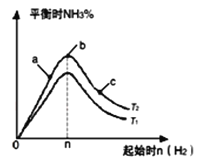
①图象中T2和T1的关系是:T2_____T1(填“>”、“<”、“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是___(填字母)。
【答案】2△H1+△H2 小 温度 AB > < c
【解析】
(1) 根据盖斯定律,①×2+②可得N2(g)+3H2(g)2NH3(g),反应热也进行相应计算;
(2) 随Y值增大,φ(NH3)减小,反应N2(g)+3H2(g)2NH3(g)△H<0向逆反应方向移动,正反应为体积减小的放热反应,故Y为温度,则X为压强,增大压强平衡正向移动,φ(NH3)增大;
(3) A.I为恒温恒容,随反应进行压强减小,Ⅱ为恒温恒压,Ⅱ相当于在I的基础上增大压强,平衡正向移动,Ⅱ中反应物转化率大于Ⅰ;
B.Ⅲ为恒容绝热,随反应进行温度升高,I为恒温恒容,Ⅲ相当于在I的基础上升高温度,平衡逆向移动;
C.平衡常数只受温度影响,温度相同,平衡常数相同;
D.Ⅱ相当于在I的基础上增大压强,平衡正向移动,氨气体积分数增大;
(4)再次充入0.2mol N2,0.6mol H2和1.6molNH3等效于再次充入1molN2和3molH2,结合勒夏特列原理分析;
(5)①由图可知,n(H2)相同时,T2对应氨气含高,反应为放热反应,降低温度有利于生成氨气;
②a、b、c三点,n(H2)越大,平衡正向移动的程度越大,N2的转化率越大。
(1) 已知:①NH3(l)NH3(g)△H1,②N2(g)+3H2(g)2NH3(l)△H2,根据盖斯定律,①×2+②可得:N2(g)+3H2(g)2NH3(g),故△H=2△H1+△H2;
(2) 随Y值增大,φ(NH3)减小,反应N2(g)+3H2(g)2NH3(g)△H<0向逆反应方向移动,正反应为体积减小的放热反应,故Y为温度,则X为压强,增大压强平衡正向移动,φ(NH3)增大,a点的数值比b点小;
(3) A.I为恒温恒容,随反应进行压强减小,Ⅱ为恒温恒压,Ⅱ相当于在I的基础上增大压强,平衡正向移动,Ⅱ中反应物转化率大于Ⅰ,放出热量:Ql<Q2<|H|,故A正确;
B.Ⅲ为恒容绝热,随反应进行温度升高,I为恒温恒容,Ⅲ相当于在I的基础上升高温度,平衡逆向移动,N2的转化率:I>III,故B正确;
C.平衡常数只受温度影响,温度相同,平衡常数相同,则平衡常数:II=I,故C错误;
D.Ⅱ相当于在I的基础上增大压强,平衡正向移动,则达平衡时氨气的体积分数:I<II,故D错误;
故答案为AB;
(4) 再次充入0.2mol N2,0.6mol H2和1.6molNH3等效于再次充入1molN2和3molH2,在恒温恒容容器中,相当于增大压强,平衡正向移动,重新达平衡时NH3的体积分数>10%;
(5)①由图可知,n(H2)相同时,T2对应氨气含高,反应为放热反应,降低温度有利于生成氨气,则T2<T1 ;
②a、b、c三点,n(H2)越大,平衡正向移动的程度越大,N2的转化率越大,c点时氢气的物质的量最大,c点N2的转化率最高,故答案为:c。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氮是我们熟悉的典型非金属元素,研究氮及其化合物的性质对于生产、生活、科研具有重要意义,请回答以下问题:
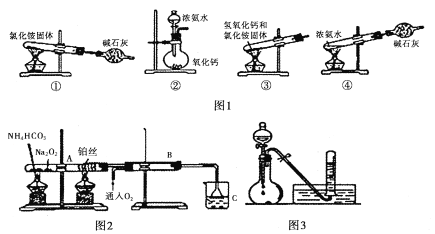
I. (1)图1为制取氨气的装置和选用的试剂,其中合理的是______________(填字母)。
A,①② B. ②③ C. ②④ D. ①③
(2)实验室制备氨气的化学方程式是____________________________________。
II. 图2位铵盐的受热分解装置
(1)被加热的铂丝处发生反应的化学方程式为____________________________________。
(2)B中出现的现象为_______________________________________________________。
(3)如图3:将上述烧杯C中反应得到酸的足量的浓溶液与Cu反应,实验完毕后,试管中收集到气体的主要成分为____________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理排放情况。
I.实验室通过如图所示装置制备Na2S2O3
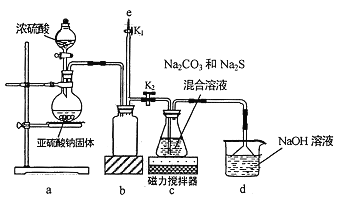
(1)实验中要控制SO2生成速率,可采取的措施有_____________(写出一条)。
(2)b装置的作用是_____________ 。
(3)反应开始后,c 中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为__________(填化学式)。
(4)实验结束后,在e处最好连接盛__________(填“NaOH 溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______________,最后拆除装置。
II.氰化钠废水处理
(5)已知: a.废水中氰化钠的最高排放标准为0.50mg/L;
b.Ag++2CN-==[Ag(CN)2]-,Ag++I-=AgI↓,AgI 呈黄色,且CN-优先与Ag+反应。
实验如下: 取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用________(填仪器名称) 盛装; 滴定终点时的现象是______________。
②处理后的废水是否达到排放标准_______(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是
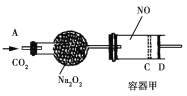
A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
① 该溶液中阴阳离子的总物质的量
② 该溶液中CuSO4的物质的量浓度
③ 取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是
A.过量的铁在1molCl2中然烧,最终转移电子数为2NA
B.在50g质量分数为46%的乙醇水溶液中,含氢原子总数为6NA
C.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
D.1L1mol/LNaCl溶液和1L1mol/LNaF溶液中离子总数:前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2H4在水中电离方式与NH3相似,若将NH3视为一元弱碱,则N2H4是一种二元弱碱,下列关于N2H4的说法不正确的是
A.它与硫酸形成的酸式盐可以表示为N2H5HSO4
B.它溶于水所得的溶液中共有4种离子
C.它溶于水发生电离的第一步可表示为:N2H4+H2O![]() N2H5+OH-
N2H5+OH-
D.室温下,向0.1mol/L的N2H4溶液加水稀释时,n(H+)·n(OH-)会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废旧电池材料的主要成分为钴酸锂(LiCoO2),还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到Co2O3和锂盐。
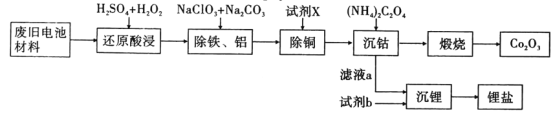
已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的C2O42-离子生成Co(C2O4)n2(n-1)-而溶解。
(1)“还原酸浸”过程中,LiCoO2发生反应的离子方程式为:___,该过程温度通常控制在40℃以下的原因是:___。
(2)“除铝铁”过程的两种试剂的作用分别是___,___。
(3)“除铜”所用试剂X为H2S,试写出该反应的离子方程式:___。并计算室温下该反应的平衡常数K=___,已知:25℃时Kap(CuS)=8.5×10-45,已知H2S在水中的的电离常数:K1=1.3×10-7,K2=7.l×10-15
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

①随n(C2O42-):N(Co2+)比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因___。
②沉淀反应时间为10 min,温度在50℃以上时,随温度升高而钴的沉淀率下降的可能原因是___。
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1mol·L-1,部分锂盐的溶解度数据如下表所示。

结合数据分析,沉锂过程所用的试剂b是___(写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,___,___,洗涤干燥。检验沉淀洗净的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HNO2是一种弱酸,向NaNO2中加入强酸可生成HNO2,HNO2不稳定,易分解成NO和NO2气体;HNO2是一种还原剂,能被常见的强氧化剂氧化,但在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐如NaNO2,则导致血红蛋白中的Fe2+转化为Fe3+而中毒,可以服用维生素C解毒,维生素C在解毒的过程中表现出_____(填“氧化”或“还原”)性。
(2)下列方法中,不能用来区分NaNO2和NaCl的是(_____)
A.加入盐酸,观察是否有气泡产生
B.加入AgNO3溶液观察是否有沉淀生成
C.分别在它们的酸性溶液中加入FeCl2溶液,观察溶液颜色变化
(3)![]() 可以与Fe2+反应制备Fe2O3纳米颗粒。
可以与Fe2+反应制备Fe2O3纳米颗粒。
① 若![]() 与Fe2+的物质的量之比为1:2,配平该反应的离子方程式:
与Fe2+的物质的量之比为1:2,配平该反应的离子方程式:
___Fe2++___![]() +___H2O2+___OH-=___Fe2O3+___
+___H2O2+___OH-=___Fe2O3+___![]() +___H2O
+___H2O
② 下列关于该反应的说法中正确的是_____(填序号)。
A.该反应中![]() 表现了氧化性
表现了氧化性
B.已知生成的Fe2O3纳米颗粒直径为10纳米,则Fe2O3纳米颗粒为胶体
C.该反应中H2O2作氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com