
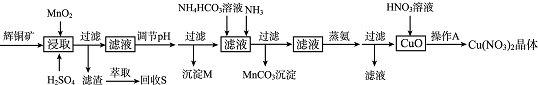
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
分析 辉铜矿主要含有硫化亚铜(Cu2S),还有Fe203、Si02及一些不溶性杂质,加入硫酸溶液及二氧化锰溶解浸取过滤,过滤得滤渣,萃取回收硫单质;在滤液中调节溶液的pH值,使铁离子沉淀而除去,所以沉淀M为氢氧化铁,过滤在滤液中加碳酸氢铵和氨气得碳酸锰沉淀,将滤液进行蒸氨、过滤得氧化铜,氧化铜中加入硝酸,经过蒸发浓缩、降温结晶得到硝酸铜晶体,
(1)反应物是二氧化锰、硫化铜和硫酸,生成物是S、硫酸铜、硫酸锰,根据化合价升降相等配平;
(2)调节pH使铁离子沉淀,根据表中数据使铁离子溶液完全且不使铜离子沉淀判断pH值;
(3)锰离子与碳酸氢根离子在氨水中生成碳酸锰沉淀和铵根离子;
(4)根据上面的分析可知,操作A是从硝酸铜溶液中获得硝酸铜晶体,注意硝酸铜是受热能分解的物质,据此答题;
(5)根据反应①2Cu2S(s)+302 (g)═2Cu20(s)+2SO2(g)△H=-768.2kJ.mol-l,②2Cu20(s)+Cu2S(s)═6Cu(s)+S02(g)△H=+116.O kJ.mol-l,利用盖斯定律可知,将(①+②)÷3即得Cu2S与02加热反应生成Cu的热化学方程式;
(6)根据铜元素守恒可计算出Cu(N03)2的质量.
解答 解:辉铜矿主要含有硫化亚铜(Cu2S),还有Fe203、Si02及一些不溶性杂质,加入硫酸溶液及二氧化锰溶解浸取过滤,过滤得滤渣,萃取回收硫单质;在滤液中调节溶液的pH值,使铁离子沉淀而除去,所以沉淀M为氢氧化铁,过滤在滤液中加碳酸氢铵和氨气得碳酸锰沉淀,将滤液进行蒸氨、过滤得氧化铜,氧化铜中加入硝酸,经过蒸发浓缩、降温结晶得到硝酸铜晶体,
(1)反应物是二氧化锰、硫化铜和硫酸,生成物是S、硫酸铜、硫酸锰,反应方程式为2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,
故答案为:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;
(2)调节pH使铁离子转化成氢氧化铁完全沉淀,根据表中数据使铁离子溶液完全3.2≤pH,且不使铜离子沉淀pH<4.4,所以pH值范围为3.2≤pH<4.4,
故答案为:铁离子转化成氢氧化铁完全沉淀;3.2≤pH<4.4;
(3)锰离子与碳酸氢根离子在氨水中生成碳酸锰沉淀和铵根离子,反应的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+,
故答案为:Mn2++NH3+HCO3-=MnCO3↓+NH4+;
(4)根据上面的分析可知,操作A是从硝酸铜溶液中获得硝酸铜晶体,注意硝酸铜是受热能分解的物质,所以操作A为蒸发浓缩、冷却结晶,
故答案为:蒸发浓缩、冷却结晶;
(5)根据反应①2Cu2S(s)+302 (g)═2Cu20(s)+2SO2(g)△H=-768.2kJ.mol-l,②2Cu20(s)+Cu2S(s)═6Cu(s)+S02(g)△H=+116.O kJ.mol-l,利用盖斯定律可知,将(①+②)÷3即得Cu2S与02加热反应生成Cu的热化学方程式为Cu2S(s)+02 (g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l ,
故答案为:Cu2S(s)+02 (g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l;
(6)1.0kg这样的辉铜矿含有Cu2S的质量为85%×1.0kg,根据铜元素守恒可知,能生成Cu(N03)2的质量为:1.0kg×85%×95%×(1-3%)×(1-5%)×$\frac{188×2}{160}$=1.75kg,
故答案为:1.75.
点评 本题考查了物质分离提纯的方法和流程判断,主要是物质性质的理解应用和实验基本操作,掌握基础是关键,题目难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 增重30% | B. | 一定增加 | C. | 可能不变 | D. | 减轻30% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
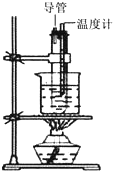 用苯和浓硝酸、浓硫酸按照如图装置制取硝基苯,回答下列问题:
用苯和浓硝酸、浓硫酸按照如图装置制取硝基苯,回答下列问题: ;反应类型:取代反应.
;反应类型:取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C<D | |
| B. | 非金属性:A>C | |
| C. | B和D最高价氧化物对应水化物相互不反应 | |
| D. | 单质B常温下能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | N、O、F元素最高正化合价依次升高 | |
| C. | P、S、Cl原子半径依次增大 | |
| D. | Na、K、Rb的第一电离能依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
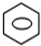 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$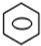 -NO2+H2O
-NO2+H2O ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com