
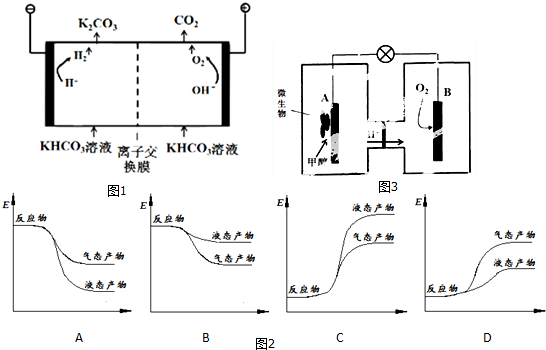
分析 (1)①KHCO3溶液中的碳酸氢根离子水解大于电离,溶液呈碱性;
②装置图分析与电源正极相连的为电解池的阳极,与电源负极相连的为电解池的阴极,阳极上是氢氧根离子失电子生成氧气;
③水电离出的氢离子放电生成氢气,同时产生的氢氧根离子与碳酸氢根离子结合成水和碳酸根离子;
④碳酸氢根离子程度电离平衡、氢氧根离子和碳酸氢根离子反应生成碳酸根离子,来确是阴阳离子交换膜;
(2)①阳极热化学方程式和盖斯定律计算得到所需热化学方程式;
②依据写出的热化学方程式是放热反应,反应物能量高于生成物,生成的气体甲醇和水蒸气,甲醇和水蒸气变化为液体放热,结合图象分析判断;
(3)①原电池原理分析,甲醇在负极失电子发生氧化反应,氧气在正极得到电子发生还原反应,电子从负极氧外电路流向正极;
②B电极反应是氧气得到电子生成氢氧根离子在酸性溶液中生成水,氢离子通过交换膜移向正极,溶液PH不变;
③A电极是原电池负极失电子发生氧化反应,在酸溶液中生成二氧化碳.
解答 解:(1)①KHCO3溶液中的碳酸氢根离子水解大于电离,溶液呈碱性,所以离子浓度的大小为:c(K+)>c(HCO3-)>c(OH-)>c(H+),故答案为:c(K+)>c(HCO3-)>c(OH-)>c(H+);
②装置图分析与电源正极相连的为电解池的阳极,与电源负极相连的为电解池的阴极,阳极上是氢氧根离子失电子生成氧气,电极反应为:4OH--4e-═2H2O+O2↑,
故答案为:4OH--4e-═2H2O+O2↑;
③水电离出的氢离子放电生成氢气,同时产生的氢氧根离子与碳酸氢根离子结合成水和碳酸根离子,反应的离子方程式为:HCO3-+OH-=CO32-+H2O,故答案为:HCO3-+OH-=CO32-+H2O;
④HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电浓度减小平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生,所以碳酸氢根离子可以自由通过,即是阴离子交换膜,
故答案为:阴;
(2)①a、H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
b、CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
阳极盖斯定律a×3-b得到CO2和H2生成气态甲醇等产物的热化学方程式:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol;
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol;
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol;反应是放热反应,反应物能量高于生成物,生成的气态检出和水变化为液体会放出热量,分析图象可知A符合;
故答案为:A;
(3)①原电池原理分析,甲醇在负极失电子发生氧化反应,氧气在正极得到电子发生还原反应,电子从负极氧外电路流向正极,即A到B;
故答案为:从A到B;
②B电极反应是氧气得到电子生成氢氧根离子在酸性溶液中生成水,氢离子通过交换膜移向正极,溶液PH不变,故答案为:不变:
③A电极是原电池负极失电子发生氧化反应,在酸溶液中生成二氧化碳,电极反应依据氢离子进行电荷配平得到,CH3OH+H2O-6e-═6H++CO2↑,
故答案为:CH3OH+H2O-6e-═6H++CO2↑.
点评 本题考查了热化学方程式书写,推断出和电解池原理的分析应用,电极名称和电极反应是解题关键,题目难度中等.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ③④⑤ | C. | ①②④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3CH2OH+CH3COOH
最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3CH2OH+CH3COOH查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中,生成物的总能量大于反应物的总能量 | |
| B. | 该反应中,断裂化学键会放出能量 | |
| C. | 乙醇的燃烧热为683.4KJ/mol | |
| D. | 反应$\frac{1}{2}$C2H5OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+$\frac{3}{2}$H2O(g)△H>-683.4KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com