
| A. | 常温常压下,78gNa2O2中含有的阴离子数是NA | |
| B. | m g ${\;}_{Z}^{A}$Xn-中所含电子数为(Z-n)mNA/A | |
| C. | 1L0.1mol/LFe(OH)3胶体中含有Fe(OH)3胶粒数为0.1NA | |
| D. | H2SO4的摩尔质量为98 |
分析 A、求出过氧化钠的物质的量,然后根据1mol过氧化钠中含2mol钠离子和1mol过氧根构成来分析;
B、求出mgAZXn-的物质的量,然后根据1molAZXn-中含(Z+n)mol电子来分析;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
D、摩尔质量的单位为g/mol.
解答 解:A、78g过氧化钠的物质的量为1mol,而1mol过氧化钠中含2mol钠离子和1mol过氧根构成,即含NA个阴离子,故A正确;
B、mgAZXn-的物质的量n=$\frac{mg}{Ag/mol}$=$\frac{m}{A}mol$,而1molAZXn-中含(Z+n)mol电子,故$\frac{m}{A}mol$中含$\frac{m(Z+n)}{A}{N}_{A}$个电子,故B错误;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故1L0.1mol/L的氢氧化铁胶体中含有的胶粒的个数小于0.1NA个,故C错误;
D、摩尔质量的单位为g/mol,故硫酸的摩尔质量为98g/mol,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜是我国使用最早的合金 | B. | 钢是用量最大、用途最广的合金 | ||
| C. | 合金的硬度一般高于各成分金属 | D. | 合金的熔点一般高于各成分金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下有浓度为0.1mol/L,体积为VL的氨水,向其中逐滴加入一定浓度的盐酸,得到如图的滴定曲线,其中d点时两种溶液恰好完全反应.根据图象回答下列问题:
常温下有浓度为0.1mol/L,体积为VL的氨水,向其中逐滴加入一定浓度的盐酸,得到如图的滴定曲线,其中d点时两种溶液恰好完全反应.根据图象回答下列问题:| 离子浓度大小顺序 | 溶质化学式 | 溶液的pH |
| c (NH4+)>c (OH-)>c (CI-)>c (H+) | ① | >7 |
| ② | ③ | =7 |
| ④ | NH4Cl | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
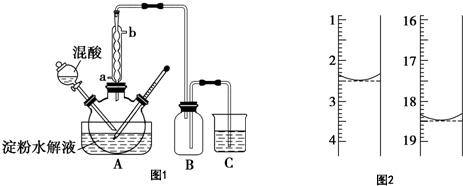
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
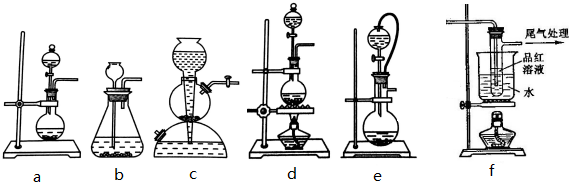

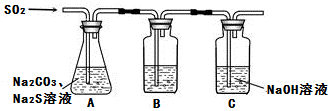
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | Al片与少量NaOH溶液反应,产生气体:2Al+2OH-+2H2O═2Al(OH)3+3H2↑ | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-═NH3•H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O═2Mn2++5O2↑+8H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com