
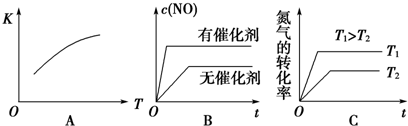
分析 (1)5分钟内,△n(O2)=1mol-0.5mol=0.5mol,由N2(g)+O2(g)?2NO(g)可知△n(N2)=0.5mol,代入v=$\frac{△n}{V•△t}$计算;
(2)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变;
(3)根据温度、催化剂对反应速率和平衡移动的影响判断;
(4)根据化学方程式的特点结合压强对平衡的影响分析;
(5)计算某时刻生成物的浓度幂之积与反应物浓度幂之积的比值,与该温度下的平衡常数相比较,可得出结论.
解答 解:(1)5分钟内,△n(O2)=1mol-0.5mol=0.5mol,由N2(g)+O2(g)?2NO(g)可知△n(N2)=0.5mol,v(N2)=$\frac{△n}{V•△t}$=$\frac{0.5mol}{2L×5min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(2)A.消耗1mol N2等效于消耗1mol O2,同时生成1mol O2,故选;
B.混合气体密度一直不变,故不选;
C.混合气体平均相对分子质量不变,总质量是个定值,总物质的量是个定值,混合气体的平均相对分子质量一直不变,故不选;
D.2v(N2)正=v(NO)正=v(NO)逆,故选;
故选:AD;
(3)(3)A、该反应的正反应为吸热反应,则升高温度平衡向正反应进行,平衡常数增大,故A正确;
B、加入催化剂,反应速率增大,但平衡不发生移动,故B错误;
C、升高温度,反应速率增大,平衡向正反应方向移动,氮气的转化率增大,故C正确;
故答案为:AC;
(4)该反应中,气体的化学计量数之和前后相等,压强对平衡移动没有影响,只要是在相同温度下,则平衡状态相同,与原平衡状态相比,此时平衡混合气中NO的体积分数,故答案为:不变;
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,则有该时刻生成物的浓度幂之积与反应物浓度幂之积的比值为:$\frac{(3×10{\;}^{-3}){\;}^{2}}{(2.5×10{\;}^{-1})×(4.0×10{\;}^{-2})}$=9×10-4<K,则反应应向正反应方向进行,则此时正、逆反应速率的大小:v正>v逆,
故答案为:向正反应方向进行;因为浓度商Qc<K;>.
点评 本题考查化学平衡的有关计算,题目难度中等,注意平衡常数的计算和应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 高温下,可用焦炭和石英砂(SiO2)制取高纯度硅 | |
| B. | CO2和钠在一定条件下可以得到金刚石和碳酸钠,反应中氧化剂和还原剂之比是4:1 | |
| C. | 用高纯度硅作为光导纤维的主要材料 | |
| D. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
| 0 | 0.80 | 1.00 | 0 |
| 1 | 0.70 | 0.80 | |
| 5 | 0.70 | ||
| 9 | 0.40 | ||
| 10 | 0.40 | 0.80 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=5.0×10-10 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ③⑤⑥ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 难溶电解质 | AgCl | AgBr | AgI | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10-17 | 1.4×10-5 | 1.12×10-12 |
| A. | 由溶度积常数不能判断相应物质的溶解性大小 | |
| B. | 将等体积的4×10-3 mol/L的AgNO3溶液和4×10-3mol/L K2CrO4溶液混合,有Ag2CrO4沉淀产生 | |
| C. | 向AgCl的悬浊液中滴加饱和NaBr溶液不能得到黄色AgBr | |
| D. | 向100 mL 0.02mol/L的NaSO4溶液中加入100mL0.02mol/L的AgNO3溶液,有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com