
【题目】下列叙述正确的是()
A.最高正化合价:P>N>CB.第一电离能:Li>Na>K
C.热稳定性:H2O>HF>H2SD.碱性:LiOH>NaOH>KOH
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( ) 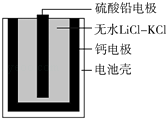
A.正极反应式:Ca+2Cl﹣﹣2e﹣═CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知98%的浓硫酸的物质的量浓度为18.4mol/L,则49%的硫酸的物质的量浓度 ( )
A. 等于9.2 mo1/L B. 小于 9.2 mo1/L
C. 大于 9.2 mo1/L D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是中学化学常见的六种单质,原子序数依次增大的短周期主族元素,其中D、E是固体,其余均为气体.图中其他物质均为化合物,六种元素都不在同一主族.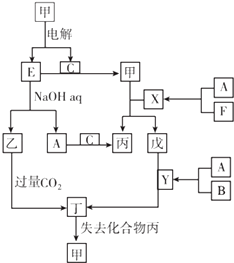
(1)写出下列物质的名称:甲 , 乙 .
(2)写出实验室制取F的化学方程式 , 检验F收集满的方法 .
(3)Y和CuO的反应方程式 .
(4)写出乙和过量CO2反应的离子方程式 .
(5)D和E形成原电池的两个电极,NaOH溶液是电解质溶液.E的一极为原电池的极,该极的电极反应式为 .
(6)73g X与足量的NaOH溶液反应放热Q kJ,写出该反应的热化学方程式 .
(7)D的最高价氧化物对应水化物的Ksp=1.8×10﹣11 , 该物质的溶液中,要使D离子的浓度降至1.8×10﹣9 mol/L,25℃时溶液的pH应调至 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝能够在空气中稳定存在的原因是( )
A. 性质不活泼,不与空气中的成分反应 B. 镁、铝与氧气的反应速率极慢
C. 经过了特殊工艺处理 D. 与氧气反应形成了氧化物保护膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0L恒容密闭容器中充入2mol SO2和1mol O2 , 发生反应:2SO2(g)+O2(g)2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前2 s 的平均速率v(O2)=0.4 molL﹣1s﹣1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3 , 达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2 , 反应达到新平衡时n(SO3)/n(O2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+而可能含Fe2+ , 进行如下实验操作时的合理顺序是 ( ) ①加足量氯水 ②加足量酸性高锰酸钾溶液 ③加足量硫氰化钾溶液
A.①③
B.②③
C.③①
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应都有沉淀生成,其中属于氧化还原反应的是( )
A. Na2SO4+BaCl2=2NaCl+BaSO4↓B. 4Fe(OH)2+O2+2H2O= 4Fe(OH)3↓
C. FeCl3+3KOH=Fe(OH)3↓+3KClD. CuCl2+2NaOH=Cu(OH)2↓+2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据课本实验设计的个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察下图的实验装置、分析实验原理,下列说法错误的是
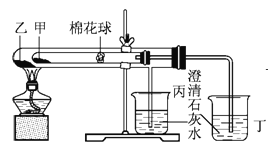
A. 甲为小苏打,乙为纯碱
B. 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 整个实验过程中可以看到丙烧杯的澄清石灰水没变浑浊
D. 同质量的甲乙完全反应消耗的同浓度的盐酸体积:甲>乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com