(2009?沈阳一模)物质A
1、A
2、B
1、B
2都是由H、N、O、Na中的三种元素组成的常见强电解质.A
1、A
2的水溶液呈碱性,相同浓度时,A
1溶液中水的电离程度小于A
2溶液中水的电离程度.B
1、B
2的水溶液呈酸性,相同浓度时,B
1溶液中水的电离程度小于B
2溶液中水的电离程度.
(1)写出A
1的电子式
,B
1化学式
HNO3
HNO3
;
(2)写出0.1mol/L B
2溶液中离子浓度的大小顺序:
C(NO3-)>C(NH4+)>C(H+)>C(OH-)
C(NO3-)>C(NH4+)>C(H+)>C(OH-)
;
(3)以铂为电极,硫酸为电解质溶液,组成氢-氧燃料电池.写出正极的电极反应式为
O2+4e-+4H+=2H2O
O2+4e-+4H+=2H2O
;
(4)钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程.其中一种办法是将钢铁制品浸到A
2和浓氢氧化钠的混合溶液中加热到130℃反应.其过程中一步可以用如下化学方程式表示,完成并配平该方程式(其中Fe和A
2的物质的量之比为3:1):
3
3
Fe+
1NaNO2
1NaNO2
+
5
5
NaOH=
3
3
Na
2FeO
2+
1
1
H
2O+
1NH3
1NH3
.

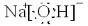
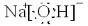
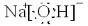 ,
,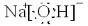 ;HNO3;
;HNO3;
