
| A. | Na2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 | |
| B. | 湿法中FeO42-是氧化产物;干法中O2也是氧化产物 | |
| C. | 干法中每生成1mol Na2FeO4,这个反应共转移4mol电子 | |
| D. | 高铁酸钠中铁显+6价,它在氧化还原反应中通常被还原 |
分析 A.Na2FeO4具有强氧化性,可氧化具有强还原性的物质,Fe(OH)3胶体具有吸附性;
B.湿法中只有Fe以上化合价升高,干法中Fe、O以上化合价都升高;
C.根据该反应中Na2FeO4 和转移电子之间的关系式计算;
D.根据化合物中化合价的代数和为0计算铁元素化合价.
解答 解:A.K2FeO4具有强氧化性,能氧化还原性的物质,如二氧化硫和氯化氢,利用其强氧化性能杀菌消毒,生成的Fe(OH)3胶体具有吸附性,能吸附悬浮物,故A正确;
B.湿法中只有Fe以上化合价升高,干法中Fe、O以上化合价都升高,则湿法中FeO42-是氧化产物;干法中O2也是氧化产物,故B正确;
C.干法中每生成1molNa2FeO4,有1molFeSO4参加反应,化合价由+2价升高到+6价,转移电子4mol,生成氧气的物质的量是0.5mol,过氧化钠中失电子电子的物质的量=$\frac{1}{2}$mol[0-(-1)]×=1mol,所以该反应中共转移电子的物质的量是5mol,故C错误;
D.根据化合价代数和为0的原则可知,高铁酸钾中铁显+6价,具有强氧化性,在氧化还原反应中通常被还原,故D正确.
故选C.
点评 本题考查氧化还原反应,侧重于学生的分析、计算能力的考查,题目难度中等,注意不同制备方法的反应原理,知道从化合价变化的角度分析氧化还原反应,易错选项是C,注意该反应中FeSO4和部分过氧化钠作还原剂,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | Y和W的含氧酸均为强酸 | |
| B. | YW3分子中Y原子的杂化方式为sp2,分子的空间构型为平面三角形 | |
| C. | 由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液 | |
| D. | 因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
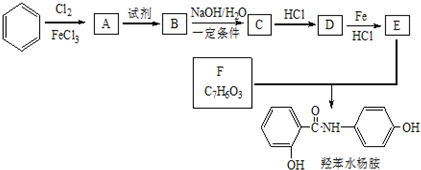
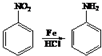
 +2NaOH$→_{一定条件}^{水}$
+2NaOH$→_{一定条件}^{水}$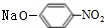 +NaCl+H2O.
+NaCl+H2O.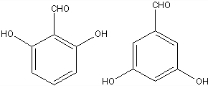 、
、 (任意一种).
(任意一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁和锌分别与相同浓度的盐酸反应,镁产生H2的速率快 | |
| B. | 铜与浓硝酸反应生成NO2,与稀硝酸反应生成NO | |
| C. | 用加热的方法可以将水中溶解的O-和N2赶出 | |
| D. | 面粉加工厂内充满粉尘,遇火易发生爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.
利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | |
| B. | 甲烷在空气中燃烧的反应 | |
| C. | 灼热的木炭与CO2的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备氯气是利用了二氧化锰的还原性 | |
| B. | 实验室制备氯气时使用过量的浓盐酸可使二氧化锰完全反应 | |
| C. | 用金属与氯气直接化合或金属与盐酸反应都可制得FeCl2 | |
| D. | 将Cl2与HCl混合气体通过四氯化碳可得到纯净的Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3(稀)→Cu(NO3)2 | ||
| C. | Cu $\stackrel{空气}{→}$CuO$\stackrel{HNO_{3}}{→}$ Cu(NO3)2 | D. | Cu$\stackrel{浓硫酸}{→}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com