
【题目】下列为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
关于已知元素C、N、S和未知的元素X、Y、Z,回答下列问题:
(1)Z元素在周期表中的位置为______________。
(2)表中元素原子半径最大的是______________ (写元素符号)。
(3)①S与Z可形成化合物S2Z2,写出它的电子式______________。
②C、N、S三元素形成的阴离子常用于检验Fe3+的存在,写出它的结构式______________。
(4)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体A、B均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol·L-1NaOH溶液和1molO2,则两种气体的分子式及物质的量分别为______________,生成硫酸铜物质的量为______________。
【答案】 第三周期ⅦA族 Si ![]() [S-C
[S-C![]() N]-或[S=C=N]- NO:0.9mol 、NO2:1.3mol 2mol
N]-或[S=C=N]- NO:0.9mol 、NO2:1.3mol 2mol
【解析】根据元素周期表的结构可知X为Si元素,Y为O元素;Z为Cl元素;
(1)Cl元素在周期表中位于第三周期第ⅦA族;(2)同一周期,从左到右,原子半径逐渐减小,同一主族,从上到下,原子半径逐渐增大,表中元素原子半径最大的是Si;(3)①S与Z可形成化合物S2Cl2,含有共价键,根据8电子稳定结构可知它的电子式为![]() ;②C、N、S三元素形成的阴离子常用于检验Fe3+的存在,化学式为SCN-,因此它的结构式[S=C=N]-;(4)铜与一定浓度的硝酸和硫酸的混合酸反应可能生成一氧化氮和二氧化氮,相对分子质量都小于50,符合题意,1molO2参与反应转移电子的物质的量为4mol。假设二氧化氮的物质的量为xmol,一氧化氮的物质的量为ymol,消耗氢氧化钠是2.2mol,根据硝酸钠的化学式结合原子守恒可知x+y=2.2,x+3y=4,解得x=1.3,y=0.9。根据电子得失守恒可知参与反应的铜的物质的量为4mol÷2=2mol,因此生成硫酸铜物质的量为2mol。
;②C、N、S三元素形成的阴离子常用于检验Fe3+的存在,化学式为SCN-,因此它的结构式[S=C=N]-;(4)铜与一定浓度的硝酸和硫酸的混合酸反应可能生成一氧化氮和二氧化氮,相对分子质量都小于50,符合题意,1molO2参与反应转移电子的物质的量为4mol。假设二氧化氮的物质的量为xmol,一氧化氮的物质的量为ymol,消耗氢氧化钠是2.2mol,根据硝酸钠的化学式结合原子守恒可知x+y=2.2,x+3y=4,解得x=1.3,y=0.9。根据电子得失守恒可知参与反应的铜的物质的量为4mol÷2=2mol,因此生成硫酸铜物质的量为2mol。


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)取等物质的量的MgO和Fe2O3的混合物进行铝热反应,反应的化学方程式为________,引发铝热反应的实验操作是____。
(2)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。写出Be与NaOH溶液反应生成Na2 [Be(OH) 4]的离子方程式__________________。
(3)5.4g某元素R的单质与足量的盐酸反应,生成RCl3和6.72L氢气,R的质子数比中子数少1个,则R的原子符号为______________,R的氧化物溶于强碱的离子方程式______________。
(4)实验室不能用带玻璃塞试剂瓶装NaOH溶液,用化学方程式和简要文字说明_____________。
(5)作为麻醉剂,氙气在医疗上很受重视,它的原子序数是____。取1mol氙气和3.5mol氟气于一密闭容器内充分反应,后来余下了1.5mol的氟气同时有白色固体生成 ,此白色固体的化学式为_________。
(6)若要使1mol CH4完全和Cl2发生取代反应,并生成相同物质的量的四种取代产物,则生成HCl的物质的量为________。
A.5 mol B.4mol
C.2.5mol D.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38.Y元素原子最外层电子数占核外总电子数的 ![]() ;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族.
;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族.
(1)写出元素符号:X , Y , Z , W .
(2)Z、W两元素最高价氧化物对应水化物反应的方程式是 .
(3)把Z的单质(片状)放入滴有酚酞的沸水中,观察到的现象是 , 反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列事实所列出的相应结论正确的是( )
实验事实 | 结论 | |
① | 铜生的锈是绿色的称为铜绿 | 铜绿是致密的氧化膜 |
② | 浓硫酸可除去烧瓶内残留的MnO2 , 稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶保存NaOH溶液 | 都发生了氧化还原反应 |
③ | 少量CO2通入Na[Al(OH)4]溶液产生白色沉淀和Na2CO3 | 酸性:HCO3﹣>Al(OH)3 |
④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀现象 | 确定该溶液存在CO |
⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH |
A.②③⑤
B.①②③
C.③④⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】字母A﹣F代表六种不同物质,它们之间可发生如图的转化(部分反应中生成物没有全部列出).其中D是一种强酸;E是一种常见金属,有“国防金属”的美誉,可在CO2中燃烧.分析图示回答下列问题: 
(1)A可以是或;
(2)E在CO2中燃烧的化学方程式为;
(3)D与F反应的化学方程式为 , 该反应中D表现了性;
(4)50mL 14molL﹣1物质D的溶液中加入足量的铜,充分反应后共收集到气体2.24L(标准状况下),则被还原的D的物质的量为mol,参加反应的铜的质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应速率的说法正确的是:
A. 用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率
B. 100 mL 2 molL﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. 反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,增加C的量 , 其反应速率增大
CO(g)+H2(g)在一可变容积的密闭容器中进行,增加C的量 , 其反应速率增大
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、MgSO4,含有少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)为加快酸溶速率,可采取的办法有______,写出酸溶时废渣中主要成分发生反应的化学方程式为_________________。
(2)加入H2O2氧化时发生发应的离子方程式为_________________。
(3)用萃取分液的方法除去溶液中的Fe3+。
①检验溶液中是否含有Fe3+的最佳试剂是_________________。
②为使Fe3+ 尽可能多地从水相转移至有机相,采取的操作:向水溶液中加入一定量的萃取剂,_______、静置、分液,并重复多次。
③萃取时,向混合溶液(含Fe2+、Al3+、Mg2+)中加入适量盐酸,使Fe2+ 与Cl-生成[FeCl4]-,再用足量的乙醚(Et2O)进行萃取,乙醚与H+结合,生成了离子Et2O·H+,由于[FeCl4]-与Et2O·H+离子容易形成缔合物Et2O·H+·[FeCl4]-。该缔合物中,Cl-和Et2O分别取代了Fe2+和H+的配位水分子,并且中和了电荷,具有疏水性,能够溶于乙醚中。因此,就从水相转移到有机相中。该萃取剂不能萃取Al3+、Mg2+的原因是_________。
(4)已知:Ksp[Al(OH)3]=1.0×10-33,Ksp[(Mg(OH)2)=1.0×10-12.pH=8.5时Mg(OH)2开始沉淀。室温下,除去MgSO4溶液中的Al3+(使其浓度小于1×10-6mol·L-1),需加入氨水调节溶液pH的范围为____________。
(5)向滤液中加入Na2CO3溶液生成MgCO3 沉淀并用蒸馏水洗涤,检验沉淀是否洗净的操作是________________。
(6)干燥时需低温干燥,温度较高时发生副反应,写出MgCO3·3H2O在323K温度时发生转化的化学方程式________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是( )
A.乙醇不能发生取代反应
B.C4H10有三种同分异构体
C.氨基酸、淀粉均属于高分子化合物
D.乙烯和甲烷可用溴的四氯化碳溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某超市中一种电池外壳的纸层包装上印有如图所示的文字,根据要求回答:
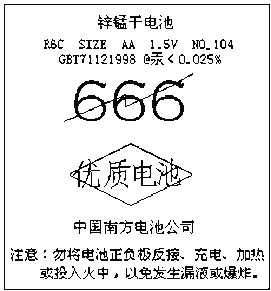
(1)该电池的种类是______(填序号).
①干电池 ②蓄电池 ③燃料电池
(2)该电池含有的金属元素中,毒性最大的是______(写元素符号).
(3)该电池的使用和性能,下列说法中不正确的是______
A.该电池可应用于闹钟、收音机、照相机等
B.该电池可充电后反复使用
C.该电池使用后不能投入火中,应埋入地下以防污染环境
(4)已知该电池的总反应为:Zn+2MnO2+2NH4Cl=ZnCl2+2NH3↑+Mn2O3+H2O,写出该电池放电时的正负极反应方程式:
负极___________________________________
正极___________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com