
分析 (2)残缺方程式配平首先确定缺什么,根据电子转移守恒,配平化学方程式;
(3)酸式滴定管可以量取具有强氧化性的溶液,高锰酸钾具有颜色,锰离子无色;
(4)根据化学方程式计算消耗过氧化氢的量然后计算质量分数;
(5)滴定实验中误差分析依据消耗标准溶液的体积变化判断产生误差的结果,
c(待测)=$\frac{c(标准溶液)V(标准溶液)}{V(待测溶液)}$,若标准溶液消耗体积越大,测定结果越高;
A.若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则有一部分溶液占据了气泡的体积;
B.观察酸式滴定管液面时,滴定前平视,滴定后俯视,读出的消耗标准溶液体积偏小;
C.滴定前,在用蒸馏水洗涤滴定管后,未用高锰酸钾标准液润洗,标准液被稀释,消耗标准溶液体积会增大;
D.滴定过程中,锥形瓶中部分溶液溅出,则消耗的标准液的体积会偏小,据此分析.
解答 解:(2)方程式中,高锰酸钾有强氧化性,能将双氧水氧化为氧气,先确定缺的是O2,锰元素化合价降低了5价,生成1mol氧气时,氧元素化合价升高2价,根据电子转移守恒,配平化学方程式高锰酸根前面的系数为2,双氧水前面的系数为5,根据原子守恒来配平其他物质前面的系数,配平得到的离子方程式为2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2,
答案为:2、5、6、2、8、5;
(3)由于高锰酸钾标准溶液具有强氧化性,所以只能使用酸式滴定管,滴定到达终点的现象是:滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色,
故答案为:酸式;滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色;
(4)根据化学方程式可以得到关系式:2MnO4-~5H2O2,耗用c mol/L KMnO4标准溶液V mL,即cV×10-3mol的高锰酸钾时,所用双氧水的物质的量:2.5cV×10-3mol,则原过氧化氢的质量为:0.025cVmol×34g/mol=0.85cV,过氧化氢溶液中过氧化氢的质量分数为:$\frac{0.85cV}{10.00ml×ρg/mol}$×100%=$\frac{0.085cV}{ρ}$×100%,
故答案为:$\frac{0.085cV}{ρ}$×100%;
(5)A.若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,有一部分溶液占据了气泡的体积,并没有滴入锥形瓶,则测定结果偏高;
B.观察酸式滴定管液面时,滴定前平视,滴定后俯视,读出的消耗标准溶液体积偏小,则测定结果偏低;
C.滴定前,在用蒸馏水洗涤滴定管后,未用高锰酸钾标准液润洗,标准液被稀释,消耗标准溶液体积会增大,则测定结果偏高;
D.滴定过程中,锥形瓶中部分溶液溅出,则消耗的标准液的体积会偏小,则测定结果偏低,
故选AC.
点评 本题是一道综合知识题目,考查角度广,要求学生具有分析和解决问题的能力,主要是滴定实验的应用分析,化学方程式定量计算,掌握基础是关键,难度中等.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在SiO2晶体中,1个Si原子和2个O原子形成两条共价键 | |
| B. | 由多种非金属元素组成的化合物一定是共价化合物 | |
| C. | HF、HCl、HBr、HI四种物质的沸点依次升高 | |
| D. | 晶体熔化时化学键不一定发生断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe3+、SO42-、Cl- | B. | CO32-、PO43-、K+、Na+ | ||
| C. | Na+、SO42-、NO3-、Cl- | D. | HCO3-、Na+、HSO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H3PO4的质量为98g.mol-1 | B. | H3PO4的摩尔质量为98 g | ||
| C. | 9.8 g H3PO4含有NA个H3PO4分子? | D. | NA个H3PO4分子的质量为98g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
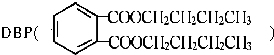 是一种常见的塑化剂,
是一种常见的塑化剂,
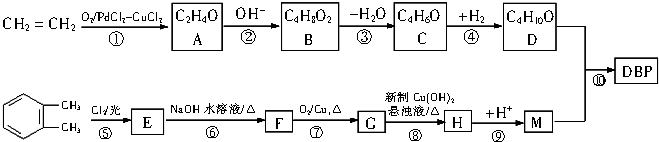
 .
. .
.
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com