
| A. | 离子键 | B. | 共价键 | C. | 金属键 | D. | 范德华力 | ||||
| E. | 氢键 |
分析 阴阳离子通过离子键结合;
原子间通过共用电子对形成共价键;
金属单质内金属阳离子与自由电子间形成金属键;
分子之间存在范德华力,即分子间作用力;
氢键:氢原子与电负性大、半径小的原子X(氟、氧、氮等)以共价键结合,若与电负性大的原子Y(与X相同的也可以)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的一种特殊的分子间或分子内相互作用,氢键为分子间作用力一种;
据此分析解答.
解答 解:硼砂是含结晶水的四硼酸钠,硼砂晶体中Na+、Xm-,二者通过离子键结合;
H2O为分子晶体,通过分子间作用力结合在一起;
水分子中氧电负性较强,能够形成氢键;
所以存在的作用力有:离子键、范德华力、氢键;
故选:ADE.
点评 本题考查了化学键及分子间作用力的判断,明确离子键、共价键、金属键概念,熟悉分子间作用力、氢键是解题关键,注意分子间作用力、氢键不是化学键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌 | |
| C. | 不慎将浓硝酸沾到皮肤上,立即用NaOH溶液冲洗 | |
| D. | 检测某溶液是否含有SO${\;}_{4}^{2-}$时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
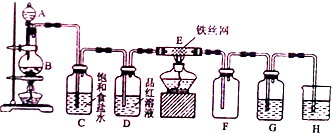
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
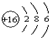 ;该元素最高正化合价与最低负化合价分别是+6和-2.
;该元素最高正化合价与最低负化合价分别是+6和-2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
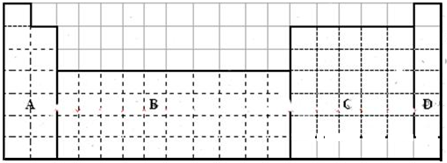
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com