
| A、原子半径最小的元素是氢,半径最大的元素是钠 |
| B、单质硅是很好的半导体材料,晶体硅是制造电子元件的重要原料 |
| C、副族元素全都是金属元素 |
| D、稀有气体元素,在一定条件下也可以形成化合物 |


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
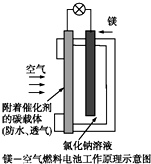 镁燃料电池作为一种高能化学电源,具有良好的应用前景.如图是镁-空气燃料电池工作原理示意图.下列有关该电池的说法正确的是( )
镁燃料电池作为一种高能化学电源,具有良好的应用前景.如图是镁-空气燃料电池工作原理示意图.下列有关该电池的说法正确的是( )| A、该电池Mg作负极,发生还原反应 |
| B、该电池的正极反应式为:O2+2H2O+4e-=4OH- |
| C、电池工作时,电子通过导线由碳电极流向Mg电极 |
| D、当电路中通过0.2 mol电子时,消耗的O2体积为1.12 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电子云图中一个小黑点表示一个电子 |
| B、电子式中元素符号周围的小黑点数表示核外电子总数 |
| C、s电子在s电子云的球形空间内做规则运动 |
| D、核外电子的能量大小主要是由电子层和电子亚层决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 起始浓度(mol/L) | 反应后溶液的pH | |
| C(HA) | C(NaOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中C(Na+)>C(A-)>C(OH-)>C(H+) | ||
B、实验①反应后的溶液中C(OH-)=C(Na+)-C(A-)=
| ||
| C、实验②反应后的溶液中C(A-)+C(HA)=0.1 mol/L | ||
| D、实验②反应后的溶液中C(Na+)=C(A-)>C(OH-)=C(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、定容时俯视液面 |
| B、转移溶液前溶液未冷却至室温 |
| C、容量瓶未干燥 |
| D、未洗涤烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
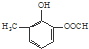 B:
B:
 ,则应加入
,则应加入查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体中阳离子和阴离子个数不一定相等 |
| B、晶体中一定有离子键,可能有共价键 |
| C、所含元素一定不在同一周期,也不在同一主族 |
| D、晶体中阳离子半径一定大于阴离子半径 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com