
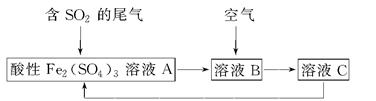
| A.溶液B中发生的反应为2SO2+O2=2SO3 |
| B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+ |
| C.由以上流程可推知氧化性:Fe3+>O2>SO42— |
| D.此工艺的优点之一是物质能循环利用 |
科目:高中化学 来源:不详 题型:多选题
| A.所得物质一定为悬浊液 | B.所得物质一定为乳浊液 |
| C.有丁达尔效应 | D.能透过滤纸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.③④⑤⑦ | B.①②⑤⑥ | C.②⑥ | D.②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
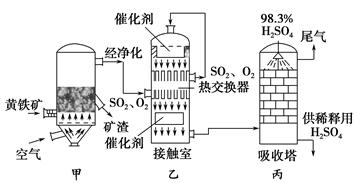
| A.硫磺和硫铁矿均可作为生产原料 |
| B.将矿石粉碎,是为了提高矿石的利用率 |
| C.反应中通入过量的空气是为了提高FeS2和SO2的转化率 |
| D.从吸收塔出来的硫酸经浓缩后可以变成发烟硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化工厂用氯气制漂白粉 | B.冶炼厂用氧化铝生产铝 |
| C.硝酸厂用氨制硝酸 | D.炼油厂分馏法生产汽油 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题: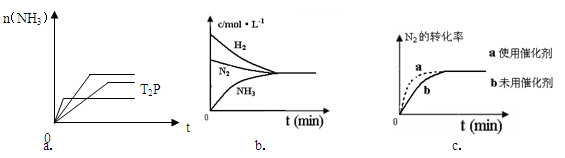
 (5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com