
| A. | 在常温、常压下,11.2L N2含有的分子数为0.5 NA | |
| B. | 0.5 NA个氯气分子的物质的量是0.5mol | |
| C. | 标准状况下,18g H2O的体积是22.4L | |
| D. | 0.1 mol•L-1稀硫酸中含硫酸根个数为0.1NA |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、物质的量n=$\frac{N}{{N}_{A}}$;
C、标况下水为液体;
D、溶液体积不明确.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,则分子个数小于0.5NA个,故A错误;
B、物质的量n=$\frac{N}{{N}_{A}}$=$\frac{0.5{N}_{A}}{{N}_{A}}$=0.5mol,故B正确;
C、标况下水为液体,故18g水的物质的量为1mol,在标况下的体积小于22.4L,故C错误;
D、溶液体积不明确,故溶液中硝酸根的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 工业上常以海带或其它海产品为原料提取碘 | |
| B. | 炼铁和制玻璃的工业中都要用到石灰石 | |
| C. | 氯气通入石灰乳中制漂白粉 | |
| D. | 电解氯化钠溶液制金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO${\;}_{4}^{2-}$ | B. | CO${\;}_{3}^{2-}$ | C. | Al3+ | D. | NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钠可用作漂白剂 | B. | 明矾可用作净水剂 | ||
| C. | 碳酸氢钠可用于治疗胃酸过多 | D. | 氧化铝可用来制造耐火坩埚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
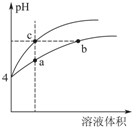 为了证明一水合氨(NH3•H2O)是弱电解质,甲、乙二人分别选用下列试剂进行实验:氨水、0.10mol•L-1NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水.
为了证明一水合氨(NH3•H2O)是弱电解质,甲、乙二人分别选用下列试剂进行实验:氨水、0.10mol•L-1NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
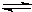 Fe(OH)3(胶体)+3H+.
Fe(OH)3(胶体)+3H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉溶于稀盐酸中 2Fe+6H+═2Fe3++H2↑ | |
| B. | 钠和水反应 Na+H2O═Na++OH-+H2↑ | |
| C. | 用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 碳酸钙与稀硝酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com