
【题目】如图所示的X、Y、Z、W四种短周期元素的原子最外层电子数之和为22,下列说法正确的是
![]()
A. X、Y、W三种元素最低价氢化物的沸点依次升高
B. Z、X、W三种元素氧化物对应水化物的酸性依次增强
C. 由X、W和氢三种元素形成的化合物中只含共价键
D. X、Z形成的二元化合物是一种新型无机非金属材料
【答案】D
【解析】
根据在短周期中,X、Y、Z、W的位置,可以知道,X和Y位于第二周期,Z和W位于第三周期,设Z元素原子的最外层电子数为a,则X、Y、W的原子的最外层电子数分别为a+1、a+2、a+3;有a +a+1+a+2+a+3=22,得a=4,Z的最外层电子数为4,Z元素为Si,同理可知X、Y、W分别为N、O、Cl。
A.X、Y、W三种元素最低价氢化物分别为NH3、H2O、HCl,由于NH3、H2O分子间存在氢键,沸点会升高,因此沸点最高的是H2O,最低的是HCl,A项错误;
B.Z、X、W元素氧化物对应的水化物的酸性不一定增强, 如Cl的含氧酸中的HClO为弱酸,其酸性比N的最高价氧化物的水化物HNO3的弱,B项错误;
C.X、W和H三种元素形成的化合物为NH4Cl等,NH4Cl为离子化合物,其中既存在离子键又存在共价键,C项错误;
D.Z和X形成的二元化合物为氮化硅,氮化硅是一种重要的结构陶瓷材料,它是一种新型无机非金属材料,D项正确;
本题答案选D。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液![]()
![]() 精盐
精盐
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是___。
(2)在第③步操作中,选择的除杂剂NaOH不能用KOH代替,理由是___。
(3)第④步中加入过量的Na2CO3的目的是___。
(4)在第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、___(填化学式)。
(5)写出第⑥步操作反应的离子方程式:___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2KClO3 + H2C2O4 + H2SO4= K2SO4 + 2ClO2 + 2CO2 + 2H2O。
(1)用单线桥法表示该反应的电子转移的方向和数目_______。
(2)该反应的氧化剂是____,还原剂是_____,氧化产物是_____,还原产物是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述不正确的是
A. 常温常压下,1 mol氦气中含有的质子数为2NA
B. l0g46%乙醇水溶液中所含氧原子数为0.4NA
C. 1 Ll mol/LNa2CO3溶液中,阴离子总数小于NA
D. 浓硝酸热分解生成NO2、N2O4共23g,转移电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
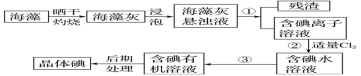
(1)实验室灼烧海带,需要下列仪器中的___(填字母)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f. 酒精灯
(2)指出提取碘的过程中有关的实验操作名称:
①____,③____。
(3)提取碘的过程中,可选择的有机试剂是___。
A.苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、酒精
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有___、__。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
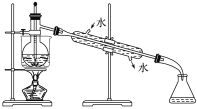
①_____;
②_____;
③_____。
(6)进行上述蒸馏操作时,使用水浴加热的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:
2A(g)+B(g)![]() 2C(g) ΔH>0。
2C(g) ΔH>0。
达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )

选项 | x | y |
A | 再通入A | B的转化率 |
B | 加入催化剂 | A的体积分数 |
C | 压强 | 混合气体的总物质的量 |
D | 温度 | 混合气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20 ℃时,饱和氯化钾溶液的密度为1.174 g/mL,物质的量浓度为4.0 mol/L,则下列说法中正确的是
A.25 ℃时,饱和氯化钾溶液的浓度小于4.0 mol/L
B.此溶液中氯化钾的质量分数为![]() ×100%
×100%
C.20 ℃时,密度小于1.174 g/mL的氯化钾溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g/mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如下:

已知:ⅰ分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3—![]() Ag++2SO
Ag++2SO![]()
ⅲ“分铜”时各元素的浸出率如下表所示。

(1)由表中数据可知,Ni的金属性比Cu______。分铜渣中银元素的存在形式为(用化学用语表示)______。“分铜”时,如果反应温度过高,会有明显的放出气体现象,原因是_______。
(2)“分金”时,单质金发生反应的离子方程式为________。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。

“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为_______。调节溶液的pH不能过低,理由为______(用离子方程式表示)。
(4)已知Ksp[Ag2SO4]=1.4×10-5,沉银时为了保证不析出Ag2SO4,应如何控制溶液中SO42—浓度(假定溶液中Ag+浓度为0.1mol/L)。________。
(5)工业上,用镍为阳极,电解0.1 mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:

为获得髙纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为_______g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳氧化合物、氢氧化合物、硫氧化合物等大气污染物的处理对缓解环境污染、能源危机具有重要意义。工业上处理氮的氧化物途径有多种:
I.氨吸法。
(1)已知:①![]()
![]()
②![]()
![]()
则用![]() 处理
处理![]() 生成氮气和气态水的热化学方程式为____________________。
生成氮气和气态水的热化学方程式为____________________。
Ⅱ.催化氧化法:城市中![]() 和
和![]() 污染主要来源于汽车尾气,可以利用化学方法将其转化为无害的物质如:
污染主要来源于汽车尾气,可以利用化学方法将其转化为无害的物质如:![]() 。
。
(2)为研究汽车尾气转化为无毒无害的物质有关反应,在密闭容器中充入![]() 和
和![]() ,发生反应,如图为平衡时
,发生反应,如图为平衡时![]() 的体积分数与温度、压强的关系。
的体积分数与温度、压强的关系。

①该反应达到平衡后,为在提高反应速率同时提高![]() 的转化率,可采取的措施有_____________(填字母序号)
的转化率,可采取的措施有_____________(填字母序号)
a.改用高效催化剂b.缩小容器的体积c.升高温度d.增加![]() 的浓度
的浓度
②压强为![]() 、温度为
、温度为![]() 下,若反应进行到
下,若反应进行到![]() 达到平衡状态,容器的体积为
达到平衡状态,容器的体积为![]() ,用
,用![]() 的浓度变化表示的平均反应速率
的浓度变化表示的平均反应速率![]() ________,该温度下平衡常数
________,该温度下平衡常数![]() ______(用平衡分压代替平衡浓度计算,分压=总压
______(用平衡分压代替平衡浓度计算,分压=总压![]() 物质的量分数;保留两位有效数字)。
物质的量分数;保留两位有效数字)。
③若在![]() 点对反应容器降温的同时缩小体积至体系压强增大,达到的平衡状态可能是图中
点对反应容器降温的同时缩小体积至体系压强增大,达到的平衡状态可能是图中![]() 点中的_____点
点中的_____点
Ⅲ.电解硝酸工业的尾气![]() 可制备
可制备![]() ,其工作原理如图
,其工作原理如图

(3)![]() 极的电极反应式为_________________。
极的电极反应式为_________________。
(4) 在![]() 时,将
时,将![]() 氨水与
氨水与![]() 的硝酸等体积混合后溶液显中性,用含
的硝酸等体积混合后溶液显中性,用含![]() 的代数式表示
的代数式表示![]() 的水解常数
的水解常数![]() _______
_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com