
分析 (1)根据v=$\frac{\frac{△n}{V}}{△t}$计算出前1min内用X的浓度变化表示的平均反应速率;
(2)根据1min末已生成0.2mol W计算出消耗Y的物质的量,然后根据c=$\frac{n}{V}$计算出1min末时Y的浓度;
(3)根据反应速率与化学计量数成正比计算出n.
解答 解:(1)前1min内用X的浓度变化表示的平均反应速率为:v(X)=$\frac{\frac{0.2mol}{2L}}{1min}$=0.1mol•L-1•min-1,
答:前1min内用X的浓度变化表示的平均反应速率为0.1 mol•L-1•min-1;
(2)根据反应2X(g)+Y(g)═nZ(g)+2W(g)可知,1min末时消耗Y的物质的量为:0.2mol×$\frac{1}{2}$=0.1mol,则1min时Y的浓度为:c(Y)=$\frac{0.6mol-0.1mol}{2L}$=0.25mol/L,
答:1min末时Y的浓度为0.25 mol/L;
(3)1min内用X的浓度变化表示的平均反应速率为v(X)=0.1mol•L-1•min-1,以Z的浓度变化表示的反应速率为0.005mol•L-1•s-1=0.3mol•L-1•min-1,反应速率与化学计量数成正比,则:0.1mol•L-1•min-1:0.3mol•L-1•min-1=2:n,解得:n=6,
答:化学反应方程式中n=6.
点评 本题考查了化学平衡的计算,题目难度中等,涉及化学反应速率、物质的量浓度的计算及化学反应速率与化学计量数的关系,明确化学反应速率的概念及表达式为解答关键,试题培养了学生的分析能力及化学计算能力.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:多选题
| A. | 制备Fe(OH)3胶体:0.2 mol•L-1 FeCl3溶液与0.6 mol•L-1 NaOH溶液等体积混合 | |
| B. | 排除碱式滴定管尖嘴部分的气泡:将胶管弯曲使玻璃尖嘴端向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 | |
| C. | 测定浓度均为0.1mol•L-1 CH3COONa与HCOONa溶液的pH,不能比较CH3COOH与HCOOH酸性的强弱 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2ml5%H2O2和1mlH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
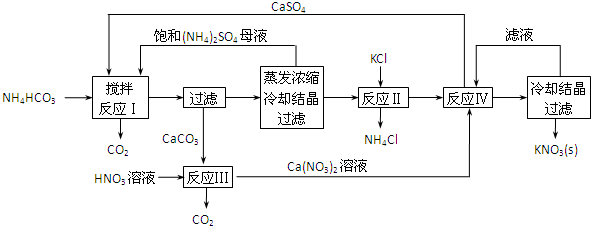
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
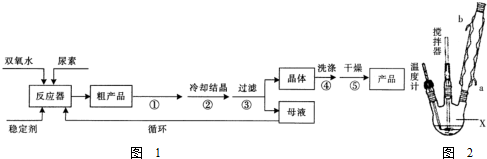
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 位于周期表中同一周期的元素,原子具有相同的电子层数 | |
| B. | 凡是位于周期表中同一主族的元素,原子具有相同的最外层电子数 | |
| C. | 凡是位于周期表中同一周期的元素,都是按从左到右的顺序原子核外最外层电子数由1递增至8 | |
| D. | 凡是位于周期表中同一主族的元素,都是按从上到下的顺序原子核外电子层数逐渐递增 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
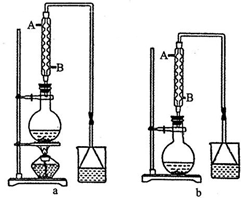 实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题.
实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 预测现象 |
| A | 将SO2通入紫色石蕊溶液中 | 石蕊溶液先变红后褪色 |
| B | 将CO2气体通入足量的CaCl2溶液中 | 产生白色沉淀 |
| C | 常温下,将用砂纸打磨过的铝片投入浓硫酸中 | 产生刺激性气体 |
| D | 将酸性高锰酸钾溶液滴入足量的乙醇中 | 高锰酸钾溶液褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
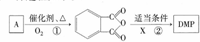
 )是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示:
)是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示: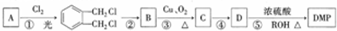
 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com