
| A. | 甲烷的球棍模型: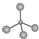 | B. | (CH3)3COH的名称:2,2二甲基乙醇 | ||
| C. | 乙醛的结构式:CH3CHO | D. | 羟基的电子式: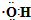 |
分析 A.球棍模型主要体现的是分子的空间结构和成键类型,比例模型主要体现的是组成该分子的原子间的大小关系与原子间连接,甲烷分子式为CH4,C原子形成4个C-H,为正四面体结构,图示碳原子半径比氢原子大错误;
B.含有羟基最长的碳链有3个碳原子,有1个甲基在2号碳上;
C.结构式是表示用元素符号和短线表示化合物(或单质)分子中原子的排列和结合方式的式子;
D.羟基是电中性基团,氧原子与氢原子以1对共用电子对连接.
解答 解:A.球棍模型表现原子间的连接与空间结构,甲烷分子式为CH4,C原子形成4个C-H,为正四面体结构,碳原子半径大于氢原子半径,球棍模型为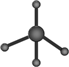 ,故A错误;
,故A错误;
B.(CH3)3COH中含有羟基最长的碳链有3个碳原子,有1个甲基在2号碳上,名称为:2-甲基-2-丙醇,故B错误;
C.乙醛的结构式为: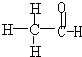 ,结构简式为:CH3CHO,故C错误;
,结构简式为:CH3CHO,故C错误;
D.羟基是电中性基团,氧原子与氢原子以1对共用电子对连接,电子式为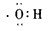 ,故D正确;
,故D正确;
故选D.
点评 本题考查常用化学用语,涉及球棍模型、醇的命名、电子式、结构式等,题目难度不大,注意掌握结构简式、结构式的区别、注意球棍模型原子间的大小关系与原子间连接.


科目:高中化学 来源: 题型:选择题
| A. | 过量二氧化碳通入偏铝酸钠溶液中:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| B. | 在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合:NH4++HSO3-+2OH-═SO32-+NH3↑+2H2O | |
| C. | 氯气通入冷的烧碱溶液中:2Cl2+2OH-═3Cl-+ClO-+H2O | |
| D. | 碳酸氢镁溶液中加入过量的石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
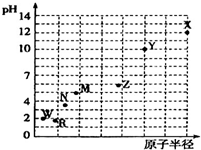 第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )
第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )| A. | 气态氢化物的稳定性:R>W | |
| B. | Z的最高价氧化物对应的水化物能溶于稀氨水 | |
| C. | Y的单质是制造汽车、飞机、火箭的重要材料 | |
| D. | 简单离子的半径X的最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和纳米管互为同分异构体 | B. | N5和N2互为同素异形体 | ||
| C. | 14C的质子数为14 | D. | C原子半径比N原子半径小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 减少污染、保护环境是全世界最热门的课题.
减少污染、保护环境是全世界最热门的课题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com