
| A、室温下,pH=2的酸溶液与pH=12的强碱溶液等体积混合,所得溶液pH≤7 |
| B、某溶液中加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变混浊,原溶液中一定含有大量CO32-或SO32- |
| C、某试液中加入盐酸酸化的氯化钡溶液,有白色沉淀,该溶液中一定含有SO42- |
| D、0.1mol/L弱酸HA溶液与 0.05mol/LNaOH溶液等体积混合后,所得溶液微粒浓度是2c(H+)+c(HA)=c(A-)+2c(OH-) |


科目:高中化学 来源: 题型:
| A、直接加热蒸干FeCl3溶液,可得FeCl3固体 |
| B、加入催化剂可加快反应速率,并提高反应物的转化率 |
| C、pH值相同的CH3COOH溶液和NH4Cl溶液中,水的电离程度相同 |
| D、可用Na2CO3溶液处理水垢中的CaSO4,转化为易于除去的CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCL3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 学生甲 | 学生乙 | |
| A | 向碳酸氢钠溶液中逐渐加入盐酸 | 向盐酸中逐滴加入碳酸氢钠溶液 |
| B | 向氯化亚铁溶液中滴加KSCN溶液,再通入氯气 | 向氯化亚铁溶液中通入氯气,再滴加KSCN溶液 |
| C | 向三氯化铝溶液中滴加氢氧化钠溶液 | 向氢氧化钠溶液中滴加入三氯化铝溶液 |
| D | 向BaCl2溶液中通入二氧化硫 | 向BaCl2溶液中通入SO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶电解质 | AgCl | AgBr | AgI | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10-17 | 1.4×10-5 | 1.12×10-12 |
| A、Ksp的大小与三种卤化银见光分解的难易无关 |
| B、将等体积的4×10-3mol?L-1的AgNO3溶液和4×10-3mol?L-1K2CrO4溶液混合,有Ag2CrO4沉淀产生 |
| C、向AgCl的悬浊液中滴加饱和Nal溶液可以得到黄色AgI悬浊液 |
| D、向100 mL 0.1mol?L-1的Na2SO4溶液中加入1 mL 0.1 mol?L-1的AgNO3溶液,有白 色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
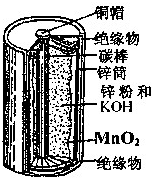
| A、MnO2是氧化剂,被氧化 |
| B、碳棒为负极、锌筒为正极 |
| C、放电过程中NH4+向锌极移动 |
| D、负极反应为:Zn-2e-+2OH-═Zn(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com