
【题目】在铁和铜的混合物中,加入不足量的稀硝酸,反应后剩余金属m1g;再向其中加入一定量的稀硫酸,充分振荡后 ,剩余金属m2g,则m1和 m2之间的关系是( )
A.m1一定大于m2 B.m1 可能等于m2
C.m1一定等于m2 C.m1 可能大于m2
科目:高中化学 来源: 题型:
【题目】向50ml物质的量浓度均为0.1mol/L (NH4)2SO4、Al2(SO4)3溶液中逐滴滴入0.1mol/L Ba(OH)2溶液200ml,随着Ba(OH)2溶液体积的变化,沉淀总物质的量(n)的变化如图所示。下列叙述不正确的是
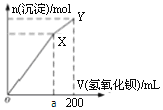
A.a=150
B.Y点对应溶液为氨水
C.OX、XY两段沉淀种类相同
D.继续滴加Ba(OH)2溶液,发生的离子反应为Al(OH)3+OH-=AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃、101 kPa的条件下,断裂1 mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,形成1 mol H—Cl键放出431 kJ能量。
H2+Cl2===2HCl的化学反应可用下图表示:
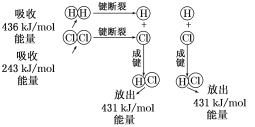
请回答下列有关问题:
(1)反应物断键吸收的总能量为_____________,生成物成键放出的总能量为_____________,1 mol H2和1 mol Cl2反应生成2 mol HCl是________(填“吸收”或“放出”)能量的反应。
(2)用电子式表示出HCl的形成过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年,“雾霾”成为年度关键词。近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题。雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成。
(1)机动车的尾气是雾霾形成的原因之一,近几年有人提出利用选择性催化剂利用汽油中挥发出来的C3H6还原尾气中的NO气体,请写出该过程的化学方程式:_____________________
(2)我国北方到了冬季烧煤供暖所产生的废气也是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,发现能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
若① N2(g)+O2(g)![]() 2NO(g) ΔH1= +180.5 kJmol-1
2NO(g) ΔH1= +180.5 kJmol-1
② CO(g)![]() C(s)+1/2O2(g) ΔH2= +110.5 kJmol-1
C(s)+1/2O2(g) ΔH2= +110.5 kJmol-1
③ C (s)+O2(g)![]() CO2(g) ΔH3= -393.5 kJmol-1
CO2(g) ΔH3= -393.5 kJmol-1
则ΔH=_____________kJmol-1。
(3)燃煤尾气中的SO2用NaOH溶液吸收形成NaHSO3溶液,在pH为4~7之间时电解,硫元素在铅阴极上被电解还原为Na2S2O4。Na2S2O4俗称保险粉,广泛应用于染料、印染、造纸、食品工业以及医学上。这种技术是最初的电化学脱硫技术之一。请写出该电解反应中阴极的电极方程式:__________。
(4)SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g) +O2(g)![]() 2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:

①该反应的化学平衡常数表达式:K=________
②图中A点时,SO2的转化率为___________
③若在T2℃,其他条件不变的情况下测得压强的变化曲线如图所示,则T1____T2(填“>”、“<”、“=”);其中C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)____vA(逆) (填“>”、“<”、“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列物质:①16O和18O ②红磷和白磷 ③CH3CH3和CH3CH2CH2CH3 ④CH3CH2CH2CH3 和CH3CH (CH3) 2 ⑤O2和O3 ⑥ 和
和
(1)属于同素异形体的是(填序号,下同) ,
(2)属于同系物的是 。
II.如图所示为CH4燃料电池的装置(A、B为多孔碳棒):
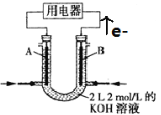
(1) (填A或B)处电极入口通甲烷,其电极反应式为 ;
(2)当消耗甲烷的体积为11.2 L(标准状况下)时,消耗KOH的质量为 g。
Ⅲ.铅蓄电池是最早使用的充电电池,由Pb、PbO2、稀硫酸构成。该电池工作时,若电路中转移2 mol电子,则负极材料质量的变化量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯气通入鼠洞中,可以用来消灭田鼠。此过程利用了下列哪些氯气的性质( )
①黄绿色 ②密度比空气大 ③有毒 ④易液化 ⑤溶于水
A.①②③ B.②③ C.③④ D.③⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某种废锂电池正极材料的主要成分是LiCoO2,含少量Al、Fe等,LiCoO2不溶于水。实验室回收废锂电池制备锂单质的流程如图所示:
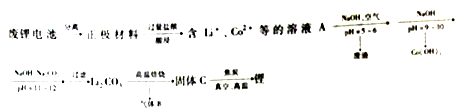
(1)正极材料酸浸时发生主要反应的化学方程式为_______。某同学从环境保护的角度考虑上述做法不合理,理由是_______,于是提出可用酸化的双氧水代替盐酸,则反应的离子方程式为______。
(2)Li2CO3在高温焙烧时发生反应的化学方程式为______。
(3)固体C与焦炭的反应需在真空条件下进行的原因是_______。
(4)工业上采用熔融盐电解法制备金属锂,电解质为熔融的LiCl-KCl,采用石墨阳极和低碳钢阴极,则阴极的电极反应式为______。如果用LiCl的水溶液代替熔融的LiCl-KCl,则其后果是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些电镀厂的酸性废水中常含有一定量的CrO42-和Cr2O72-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法,该法的工艺流程为:
![]()
其中第①步存在平衡步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=12,该溶液显________色。
(2)写出第③步的离子反应方程式:__________。
(3)第②步中,用6mol的FeSO4·7H2O可还原________molCr2O72-离子。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法:该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)写出阳极的电极反应式___________________。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)__________________________
(7)用电镀法在铁制品上镀上一层锌,则阴极上的电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com