
| A.20℃,10 mL H2SO4 | B.20℃,5 mL H2SO4,5 mL水 |
| C.30℃,5 mL H2SO4,2 mL水 | D.30℃,4 mL H2SO4,3 mL水 |
科目:高中化学 来源:不详 题型:单选题
| A.KCl固体 | B.Zn粉 | C.SO3固体 | D.CuSO4晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
| B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
| C.升高体系的温度,活化分子的百分数增大,反应速率加快 |
D.在密闭容器中进行 N2 (g)+ O2(g)  2NO(g)的可逆反应,若温度不变压强不变,充入氦气则该反应的速率加快 2NO(g)的可逆反应,若温度不变压强不变,充入氦气则该反应的速率加快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
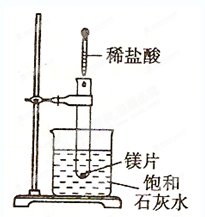
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验 序号 | 碳酸钙 状态 | C(HCl)/ mol·l-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增加硫铁矿石的投入量 | B.增加炉的高度 |
| C.降低温度 | D.升高温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入适量的铝粉 | B.加入适量的水 |
| C.加入少量的硫酸铜溶液 | D.加入浓度较大的盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g)+W(s),△H<0的反应过程。若使a曲线变为b曲线,可采用的措施是
2Z(g)+W(s),△H<0的反应过程。若使a曲线变为b曲线,可采用的措施是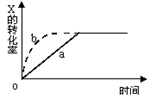
| A.增大体积 | B.增大Y的浓度 |
| C.降低温度 | D.缩小体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.对于有气体参加的化学反应来说,增大压强,可使活化分子百分数增多,化学反应速率一定增大 |
| B.升高温度,活化分子百分数不变,但是碰撞的频率增大,所以化学反应速率增大 |
| C.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
| D.加入正催化剂,可以降低该反应的活化能,会使反应物活化分子百分数增加,所以化学反应速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com