
| A. | 羟基的电子式: | B. | 乙酸的最简式:CH3COOH | ||
| C. | 苯甲醛的结构简式: | D. |  的系统命名为:4,4二甲基-2-戊烯 的系统命名为:4,4二甲基-2-戊烯 |
分析 A.羟基为中性氧原子,氧原子最外层为7个电子;
B.最简式即物质中各原子的最简单的整数比.写出各物质的分子式,进而写出最简式;
C.醛基的书写方式不正确;
D.物质为烯烃选取含碳碳双键在内的最长碳链为主碳链离碳碳双键近的一端编号得到正确名称;
解答 解:A.羟基中氧原子最外层为7个电子,氢原子最外层2个电子,羟基正确的电子式为: ,故A错误;
,故A错误;
B.乙酸分子式C2H4O2,乙酸的最简式:CH2O,故B错误;
C.苯甲醛的结构简式为: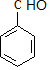 ,故C错误;
,故C错误;
D. 最长碳链5个,离双键近的一端编号得到名称4,4-二甲基-2-戊烯,故D正确;
最长碳链5个,离双键近的一端编号得到名称4,4-二甲基-2-戊烯,故D正确;
故选D.
点评 本题考查了有机物结构简式的书写,官能团判断、命名方法,题目难度不大,注意书写结构简式时,官能团不能写错.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 阿伏加德罗常数是6.02×1023 mol-1 | |
| C. | 通常状况下,1 NA 个CO2分子占有的质量为44g | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成高分子的小分子就是高分子的链节 | |
| B. | 缩聚反应的产物只有高分子 | |
| C. | 聚乙烯具有热塑性 | |
| D. | 1mol 水解后只能与1molNaOH反应 水解后只能与1molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示,圆底烧瓶中充满干燥的氯气,将胶头滴管中的浓氨水挤入圆底烧瓶中,发生反应:2NH3+3Cl2═N2+6HCl,同时生成白烟并发红光.回答下列问题.
如图所示,圆底烧瓶中充满干燥的氯气,将胶头滴管中的浓氨水挤入圆底烧瓶中,发生反应:2NH3+3Cl2═N2+6HCl,同时生成白烟并发红光.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 外电路的电流方向为:X→导线→Y | |
| B. | 若两电极都是金属,则它们的活动性顺序为X<Y | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 放电一段时间后,烧杯中溶液的酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单质的还原性:Y>X | |
| B. | 元素M与N能形成的共价化合物不止一种 | |
| C. | 通常状况下,元素Z的单质不能与元素M的氧化物反应 | |
| D. | 元素X、Y、Z的最高价氧化物对应的水化物彼此间均可发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知含铜离子的颜色主要有Cu(H2O)42+(蓝色)、CuCl42-(黄色)、Cu(NH3)42+(深蓝色)等.
已知含铜离子的颜色主要有Cu(H2O)42+(蓝色)、CuCl42-(黄色)、Cu(NH3)42+(深蓝色)等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com