
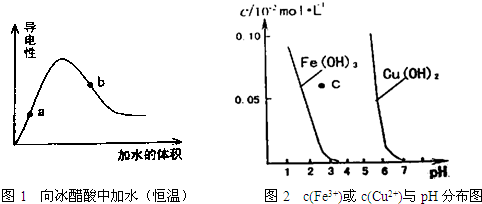
| A、图1中醋酸电离平衡常数:a点的比b点的小 |
| B、图1中醋酸溶液的pH:a点的比b点的大 |
| C、图2中c点对应的溶液为Fe(OH)3的不饱和溶液 |
| D、由图2可知,欲除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调PH约为4左右 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们的分子数目之比是 1:1 |
| B、它们的氧原子数目之比为 2:3 |
| C、它们的质量之比为 1:1 |
| D、它们所含原子数目之比为 3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、300℃、101kPa条件下,11.2L CO2和11.2L O3 所含的分子数相等 | ||
B、1mol/L NH4Cl溶液和1 mol/L CH3COONH4溶液中的c(NH
| ||
| C、2L 0.5mol/L盐酸和1L 0.5mol/L硫酸的pH相等 | ||
D、1.8 g NH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、SO2通入次氯酸钠溶液中:SO2+ClO-+H2O=SO
| ||||
B、用KI、稀硫酸及淀粉检验碘盐中IO
| ||||
C、浓氨水滴入氯化铝溶液:Al3++4NH3?H2O=AlO
| ||||
D、用两根铜棒电解盐酸:2H++2Cl-
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com