
| A. | 12种 | B. | 11种 | C. | 9种 | D. | 7种 |
分析 在浓硫酸存在下加热可生成具有待殊香味且不溶于水的物质为酯类物质,分子中含有一个羟基和一个羧基,据此解题.
解答 解:在浓硫酸存在下加热可生成具有待殊香味且不溶于水的物质为酯类物质,分子中含有一个羟基和一个羧基,该有机物可以看作,C4H10中2个H原子,分别被-COOH、-OH代替,
若C4H10为正丁烷:CH3CH2CH2CH3,2个H原子分别被-COOH、-OH代替,都取代同一碳原子上2个H原子,有2种,取代不同C原子的2个H原子,有6种,相应的同分异构体有8种;
若C4H10为异丁烷:CH3CH(CH2)CH3,2个H原子分别被-COOH、-OH代替,都取代同一碳原子上2个H原子,有1种,取代不同C原子的2个H原子,有3种,相应的同分异构体有4种;
故该有机物的可能的结构有8+4=12种.
故选A.
点评 本题考查同分异构体的书写,判断有机物含有的官能团是关键,注意取代中利用定一移二进行判断,难度中等.


科目:高中化学 来源: 题型:解答题
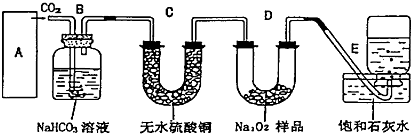

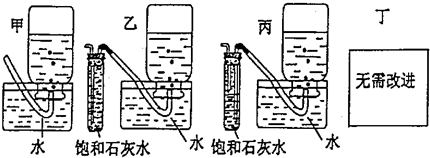
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
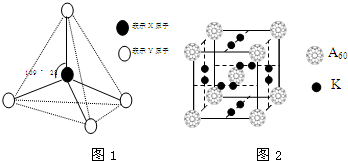 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图1所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.工业上利用单质A的同素异形体能与B物质发生置换反应,制取单质G的粗产品.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图1所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.工业上利用单质A的同素异形体能与B物质发生置换反应,制取单质G的粗产品.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.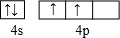 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:
近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:| 实验序号 | c(NH4+)/mol•L-1 | c(NO2-)/mol•L-1 | ν/mol•L-1•s-1 |
| 1 | 0.0100 | 0.200 | 5.4×10-7 |
| 2 | 0.0200 | 0.200 | 1.08×10-6 |
| 3 | 0.200 | 0.040 | 2.16×10-6 |
| 4 | 0.200 | 0.060 | 3.24×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知连二次硝酸(H2N2O2)是一种二元酸,25℃时,用0.01mol.L-1的盐酸滴定10mL0.01mol.L-1Na2N2O2溶液,溶液的pH与盐酸体积[V(HCl)]的关系如图所示.下法说法正确的是( )
已知连二次硝酸(H2N2O2)是一种二元酸,25℃时,用0.01mol.L-1的盐酸滴定10mL0.01mol.L-1Na2N2O2溶液,溶液的pH与盐酸体积[V(HCl)]的关系如图所示.下法说法正确的是( )| A. | M点的溶液中加人少量水,溶液的pH增大 | |
| B. | N点溶液中:c(N2O22-)+c(OH-)>c(H2N2O2) | |
| C. | P点溶液中,H2O不发生电离 | |
| D. | 溶液中$\frac{c({H}^{+})}{c(H{N}_{2}{{O}_{2}}^{-})}$:N>P>Q. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

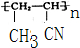
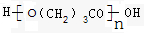
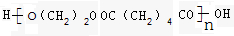 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X不可能是金属元素 | |
| B. | 元素X的气态氢化物易溶于水 | |
| C. | 元素X能形成化学式为KXO3的盐 | |
| D. | 工业上制取X的单质时一定采用氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LCl2溶于足量水中转移电子的数目为0.1NA | |
| B. | 标准状况下,22.4L苯中含有双键的数目为3NA | |
| C. | 常温下,16gO2和O3的混合气体中含有氧原子的数目为NA | |
| D. | 25℃时,pH=1的醋酸溶液中含有H+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
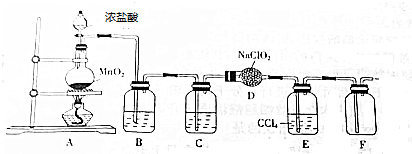
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com