
降低大气中CO2的含量、减缓温室效十分重要。
(1)工业上有一种方法是用CO2来生产甲醇:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 
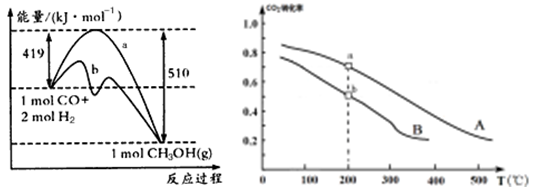
上图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。该反应是 (填“吸热”或“放热”)反应。
(2)某温度下,若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如下图实线所示。则加入催化剂的曲线是 (填:a或b);
0—8min内该反应的平均速率v(CO2)= mol/(L·min)。
(3)在CO跟O2的反应中,破坏1molCO中的化学键消耗的能量为a kJ,破坏1molO=O键消耗的能量为bkJ,形成1molC=O键释放的能量为ckJ。则1molCO在空气中完全燃烧生成CO2放出的能量为
kJ。
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:单选题
下列有关能量的判断或表示方法正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
B.从C(石墨) → C(金刚石) Q Q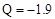 kJ,可知石墨比金刚石更稳定 kJ,可知石墨比金刚石更稳定 |
C.由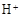 (aq) (aq) (aq) → H2O(l) (aq) → H2O(l) Q Q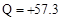 kJ,可知:含1mol CH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出热量等于57.3 kJ kJ,可知:含1mol CH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出热量等于57.3 kJ |
D.2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g) O2(g) → 2H2O(l) O2(g) → 2H2O(l) Q Q 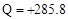 kJ kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化: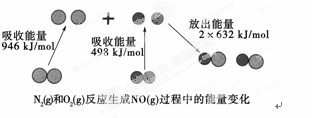
下列说法中正确的是( )
| A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ |
| B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
乙醇分子结构中各种化学键如下所示,关于乙醇在各种反应中断键的说明不正确的为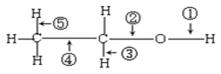
| A.和乙酸共热时,断裂①键 |
| B.和金属钠反应时,键①断裂 |
| C.和P2O5共热时,键②⑤断裂 |
| D.在铜催化下和氧气反应时,键①⑤断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可逆反应A+B(s)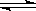 C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论正确的是( )
C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论正确的是( )
A. A为固体,C为气体,正反应为放热反应
B. A为气体,C为固体,正反应为放热反应
C. A为气体,C为固体,正反应为吸热反应
D. A、C均为气体,正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分) 碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
| A.增加碳的用量 | B.升高温度 | C.用CO吸收剂除去CO | D.加入催化剂 |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1 CO2(g)+H2(g) 的△H= kJ?mol-1。
CO2(g)+H2(g) 的△H= kJ?mol-1。 CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:| t / min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体(分子式为CH4·9H2O),则356g“可燃冰”释放出的甲烷燃烧,生成液态水时能放出1780.6 kJ的热量,则甲烷燃烧的热化学方程式可表示为:_______________________________。
(2) 在100℃时,将0.100mol的N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到下表数据: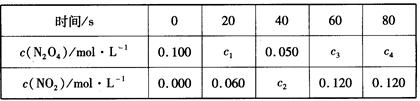
①从表中分析:该反应的平衡常数为___________;
②在上述条件下,60s内N2O4的平均反应速率为_____________;
③达平衡后下列条件的改变可使NO2浓度增大的是_________。
| A.增大容器的容积 | B.再充入一定量的N2O4 |
| C.再充入一定量的NO2 | D.再充入一定量的He |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(3分)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的是
(填序号),写出反应⑥的化学方程式__ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H=" -1275.6" kJ·mol-1
② H2O(l) H2O(g) △H=" +" 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
| 方法一 | CO(g) +2H2(g)  CH3OH(g) CH3OH(g) |
| 方法二 | CO2(g) +3H2(g)  CH3OH(g) +H2O(g) CH3OH(g) +H2O(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com