
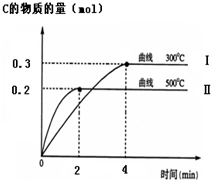
 (1)在一定条件下,xA+yB?zC,达到平衡,试填写下列空白:
(1)在一定条件下,xA+yB?zC,达到平衡,试填写下列空白:| 1 |
| 2 |
| 1 |
| 2 |
| △c |
| △t |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| c2(C) |
| c(A)×c2(B) |
| △c |
| △t |
| ||
| 2min |
| c2(C) |
| c(A)×c2(B) |


科目:高中化学 来源: 题型:
| A、NaOH溶液吸收少量H2S气体 OH-+H2S→HS-+H2O | ||
| B、向小苏打溶液中加入醋酸溶液:HCO3-+H+→CO2↑+H2O | ||
| C、碳酸氢钠溶液与少量石灰水反应 HCO3-+Ca2++OH-→CaCO3↓+H2O | ||
D、氯化铵与氢氧化钠两种浓溶液混合加热OH-+NH4+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| b | c | d | e | ||||||||||||||
| f | g | ||||||||||||||||
| h | i | ||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
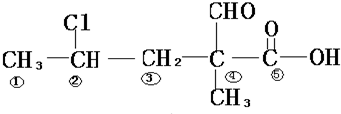
查看答案和解析>>
科目:高中化学 来源: 题型:
 反应CO(g)+H2O(g)?CO2(g)+H2(g)进行过程中的能量变化如图所示.回答下列问题:
反应CO(g)+H2O(g)?CO2(g)+H2(g)进行过程中的能量变化如图所示.回答下列问题:| 组别 | 温度(℃) | 起始浓度(mol/L) | 反应达平衡时所需时间(min) | 平衡浓度(mol/L) c(CO2)或c(H2) | |
| c(CO) | c(H2O) | ||||
| Ⅰ | 800 | 1.00 | 1.00 | 10 | 0.50 |
| Ⅱ | 800 | 1.00 | 4.00 | t2 | c2 |
| Ⅲ | 800 | 1.00 | 1.00 | 1 | 0.50 |
| Ⅳ | 1000 | 1.00 | 1.00 | 8 | 0.40 |
| Ⅴ | 1000 | 2.00 | 2.00 | t5 | c5 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com