
| A、石油的裂化属于物理变化 |
| B、氯乙烯和乙二醇均可作为合成聚合物的单体 |
| C、淀粉、蛋白质、脂肪和葡萄糖都可发生水解反应 |
| D、在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 |


科目:高中化学 来源: 题型:
| 元素 | T | X | Y | Z | W |
| 原子半径/nm | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
| A、X的阴离子半径小于T的阳离子半径 |
| B、Y的氢化物的热稳定性比Z的氢化物的大 |
| C、Y单质与Fe反应生成的化合物中,铁元素显+3价 |
| D、Z元素的氧化物对应的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.| 物质 | 沸点/℃ |
| 三苯甲醇 | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
| ①操作 |
| ②溶解、过滤 |
| ③洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
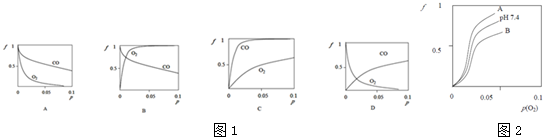
查看答案和解析>>
科目:高中化学 来源: 题型:
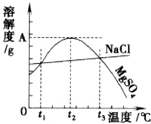
| A、只有在t1℃时,NaCl和MgSO4的溶解度才相等 |
| B、t1℃~t2℃,MgSO4的溶解度随温度升高而增大 |
| C、在t2℃时,MgSO4溶液的溶质质量分数最大 |
| D、把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
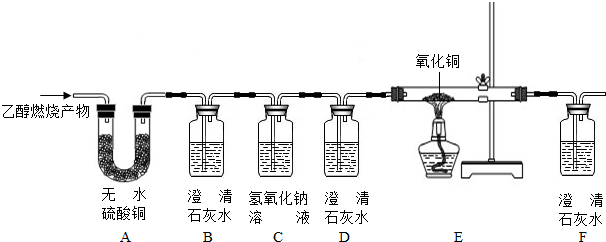
查看答案和解析>>
科目:高中化学 来源: 题型:
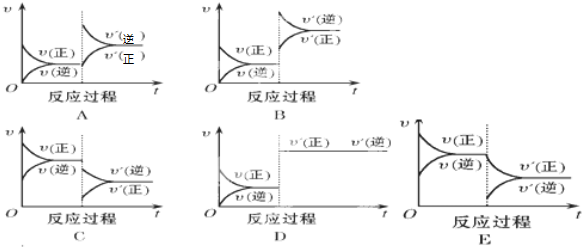
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 |  选用滴定管 选用滴定管 |
| A | 碱 | 酸 | 石芯 | (乙) |
| B | 酸 | 碱 | 酚酞 | (甲) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
| 实验 编号 | 待测氢氧化钠溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) | 消耗盐酸体积(mL) |
| ① | 25.00 | 0.02 | 26.40 | |
| ② | 25.00 | 0.04 | 25.81 | |
| ③ | 25.00 | 0.03 | 25.78 | |
| ④ | 25.00 | 0.20 | 25.96 |
查看答案和解析>>
科目:高中化学 来源: 题型:
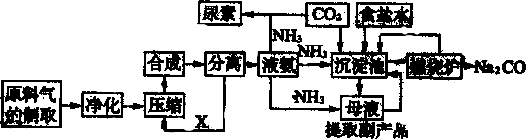
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com