
【题目】下列关于盐类水解的说法错误的是( )
A.浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为①>②>③
B.pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物质的量浓度大小:①>②>③
C.在NH4Cl溶液中加入稀HNO3,能抑制NH4+水解
D.将硫酸亚铁溶液加热蒸干得不到原溶质
【答案】A
【解析】
A.①中CO32-促进NH4+水解,②(NH4)2SO4中只有NH4+水解,③(NH4)2Fe(SO4)2中Fe2+抑制NH4+水解,所以c(NH4+)的顺序为③>②>①,故A错误;
B.等浓度时,盐类水解产生的碱性弱于碱,多元弱酸的盐的水解程度:正盐大于酸式盐,所以pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物质的量浓度大小:①>②>③,故B正确;
C.在NH4Cl溶液中,存在NH4++H2O![]() NH3·H2O+H+,加入稀HNO3,c(H+)增大,平衡逆向移动,所以能抑制NH4+水解,故C正确;
NH3·H2O+H+,加入稀HNO3,c(H+)增大,平衡逆向移动,所以能抑制NH4+水解,故C正确;
D.将硫酸亚铁溶液加热蒸干过程中亚铁离子被氧化为铁离子,最终得到的不是硫酸亚铁,故D正确。
故选A。


科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1mol/L 的CH3COOH 溶液中有1% CH3COOH 分子发生电离,则溶液的pH=______________;可以使0.10mol·L-1 CH3COOH的电离程度增大的是____________。、
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1. d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH 均等于3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液有锌粉剩余,则生成氢气的体积:V( 盐酸)________V(醋酸)(填“>”、“ <” 或“=”)。
(3)0.1mol/L 的某酸H2A 的pH=4,则H2A 的电离方程式为_________________。
(4)某温度下,Kw=1×10-12,将0.02mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混和液的pH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下来事实不能说明NH3·H2O为弱电解质的是
A. 0.1 mol·L-1NH3·H2O的pH小于13
B. 0.1 mol·L-1 NH4Cl溶液的pH小于7
C. 相同条件下,浓度均为0.1 mol·L-1 NaOH溶液和氨水,氨水的导电能力弱
D. 0.1 mol·L-1NH3·H2O能使无色酚酞试液变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是高效、低毒的消毒剂。已知:ClO2是极易溶于水的气体,实验室制备及性质探究装置如图所示。回答下列问题:
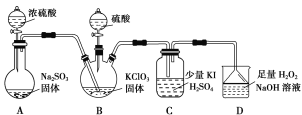
(1)装置B用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为___________。装置C中滴有几滴淀粉溶液,反应时有蓝色岀现。淀粉的作用是______。
(2)装置C的导管靠近而不接触液面,其目的是________。
(3)用ClO2消毒自来水,其效果是同质量氯气的______倍(保留一位小数)。
(4)装置D用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2∶1,则还原产物的化学式是___________。
(5)若将装置C中的溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:ClO2与Na2S不反应。
假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:___________。
②请设计实验证明你的假设(仅用离子方程式表示):__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盐类水解的应用中,说法正确的是( )
A. 加热蒸干Na2CO3溶液,最后可以得到NaOH和Na2CO3的混合固体
B. 除去MgCl2中的Fe3+,可以加入NaOH固体
C. 明矾净水的反应:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
D. 加热蒸干KCl溶液,最后得到KOH固体(不考虑与CO2的反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO![]() +2H+===Cr2O
+2H+===Cr2O![]() +H2O Ba2++CrO
+H2O Ba2++CrO![]() ===BaCrO4↓
===BaCrO4↓
步骤Ⅰ移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的________(填“上方”或“下方”)。BaCl2溶液的浓度为________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的离子是( )
A.①③⑤⑦⑧B.②④⑥⑧C.①⑥D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是
A.0.1 mol·L-1NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+) >c(OH-)
B.0.1 mol·L-1Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:C(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是
A.v (N2)=0.2molL﹣1min﹣1B.v (N2)=5molL﹣1s﹣1
C.v (NH3)=0.1molL﹣1min﹣1D.v (H2)=0.3molL﹣1min﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com