
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可
与其最高价含氧酸反应生成离子化合物,由此可知
| W | X | |
| Y | Z |
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性大于Y
D.Z元素单质在化学反应中只表现氧化性
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
为检验某溴代烃(R-Br)中的溴元素,有下列实验操作:
①加热煮沸 ②加入AgNO3溶液 ③取少量卤代烃 ④加入稀硝酸酸化 ⑤加入NaOH溶液 ⑥冷却,正确 操作的先后顺序是 ( )
操作的先后顺序是 ( )
A. ③①⑤⑥②④ B.③①②⑥④⑤
③①⑤⑥②④ B.③①②⑥④⑤
C.③⑤①⑥④② D.③⑤①⑥②④
查看答案和解析>>
科目:高中化学 来源: 题型:
溴及其化合物广泛用在有机合成、化学分析等领域。
(1)海水提溴过程中溴元素的变化如下 :
:
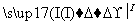
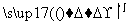
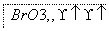
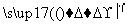
①过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气。
ⅰ.通入氯气后,反应的离子方程式是_______________________。
ⅱ.调海水pH可提高Cl2的利用率,用平衡原理解释其原因是______。
②过程Ⅱ,用热空气将溴赶出,再用浓碳酸钠溶液吸收。完成并配平下列方程式。
 Br2+
Br2+ Na2CO3===
Na2CO3=== NaBrO3+
NaBrO3+ CO2+
CO2+ ________
________
③过程Ⅲ,用硫酸酸化可得Br2和Na2SO4的混合溶液。
相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是__________是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
| 粒子 | I2 | Br2 | IO |
| 物质的量/mol | 0.5 | 1.3 |
则原溶液中NaI的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W均为短周期元素,它们在元素
周期表中相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
A.X的最常见气态氢化物的水溶液显酸性
B.最高价氧化物对应水化物的酸性W比Z强
C.Z的单质与氢气反应较W剧烈
D.X的原子半径小于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有
A.碱性:KOH>NaOH  B.相对分子质量:Ar>K
B.相对分子质量:Ar>K
C.酸性:HClO4>H2SO4 D.元素的金属性:Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项叙述中,正确的是 ( )
A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素
C.所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同
D.24Cr原子的电子排布式是1s22s22p63s23p63d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中不正确的是 ( )
A.X能形成化学式为X(OH)3的碱
B.X能与某些金属元素形成化合物
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X可能形成化学式为KXO3的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁、戊五种短周期元素原子序数依次递增。甲最
外层电子数是次外层的两倍,丙的次外层电子数比最外层少4个,丁形成的简单阳离子是同周期元素简单
离子中半径最小的,戊是同周期主族元素中原子半径最小的。试用化 学式回答下列问题:
学式回答下列问题:
(1)乙和戊形成的化合物中各原子最外层均满足8e-结构,其化学式为 ;
(2)写出乙的最高价氧化物的水化物的浓溶液与甲单质反应的化学方程式
;
(3)戊的最高价氧化物与丁的最高价氧化物的水化物反应的离子反应方程式为
;
(4) 常温下戊单质被NaOH溶液吸收的化学方程式为 ;
(5)氢与丙形成原子个数比为1:1的液体,该物质中存在的作用力有( )
①极性键 ②非极性键 ③离子键 ④氢键 ⑤范德华力
④氢键 ⑤范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,将一定量的冰醋酸(无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示。

请完成下列问题:
(1)上述a、b、c三点对应醋酸的电离程度最大的是 (填“a”、“b”、“c”),三点对应溶液中c(OH-)由大到小的顺序为 。
(2)c点对应的溶液中c(H+)与c(CH3COO-)+c(OH-)的关系为前者 (填“大于”“小于”“等于”)后者。
(3)从a点到b点,溶液中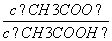 的比值 (填“增大”、“减小”、“等于”)。
的比值 (填“增大”、“减小”、“等于”)。
(4)25 ℃时,体积均为100 mL 、pH=m的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示。则稀释前两溶液中c(OH-)= , HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。

(5)若用pH试纸进行实验,你能否区分上述HX和CH3COOH两种酸溶液?若能,请简述操作过程;若不能,请说明理由。 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com