
【题目】下列反应属于吸热反应的是
A.生石灰与水的反应B.乙醇燃烧
C.铝粉与氧化铁粉末反应D.BA(OH)2·8H2O与NH4Cl的反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为__mol·L-1 (保留1位小数)。
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(ClO-)_________mol·L-1(不考虑ClO-的水解)。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法不正确的是________(填字母)。
A.如下图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.将称量好的NaClO固体在烧杯中溶解后应立即转入容量瓶
C.定容时俯视容量瓶刻度线会导致所配溶液浓度偏高
D.需要称量NaClO固体的质量为149.0g
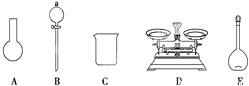
(4)该同学对容量瓶及其使用方法的认识中正确的是_______(填字母)。
A.容量瓶上标有容积、温度和浓度
B.使用前要检查容量瓶是否漏液
C.容量瓶用蒸馏水洗净后,须烘干后再使用
D.配制溶液过程中,容量瓶内液体只需要一次摇匀过程
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用18.4mol·L-1 的浓硫酸配制2L2.3molL﹣1的稀硫酸用于增强“84消毒液”的消毒能力,需用浓硫酸的体积为_____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.以下物质:①KC1晶体 ②液态HC1 ③食盐水④熔融NaC1 ⑤蔗糖 ⑥铜 ⑦CO2 ;能导电的是_________(填序号,下同);属于电解质的是________;属于非电解质的是_____________。
Ⅱ.写出下列物质在水溶液中的电离方程式。
NaHCO3 _______________________________________。
Ba(OH)2 _______________________________________。
NH3H2O_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
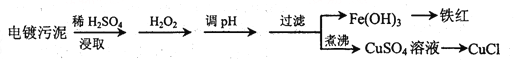
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是________________,调pH的最适宜范围为________________。
(2)调pH过程中加入的试剂最好是___________。
A. NaOH B. CuO C.NH3·H2O D.HCl
(3)煮沸CuSO4溶液的原因是_________。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式_________。
(4)过滤后的沉淀表面通常附着有一些杂质离子,为得到纯净产物,需要进行洗涤,确定沉淀洗涤干净的操作及现象是_________。
(5)称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g)△H<0.改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
2HI(g)△H<0.改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
①升高温度________;
②加入催化剂________;
③充入更多的H2________;
④保持容器中压强不变,充入氖气________;
⑤保持容器容积不变,通入氖气________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制100ml0.10molL1NaOH标准溶液,计算需称量_____g氢氧化钠固体。
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加23滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度 | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是____________________________________________.
②根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字).
③排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:___________
A. 滴定终点读数时俯视读数
B. 酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C. 锥形瓶水洗后未干燥
D. 称量NaOH固体中混有Na2CO3固体
E. 配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F. 碱式滴定管尖嘴部分有气泡,滴定后消失。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物Q适用于治疗高血压、心绞痛,可由有机物P和L制备。
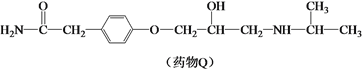
(1)有机物P的合成路线如下。

已知:![]() (R、R’、R”代表烃基或氢)
(R、R’、R”代表烃基或氢)
① A的分子式为C3H8O,其所含的官能团是_______。
② B的核磁共振氢谱只有一个吸收峰,其结构简式是_______。
③ 由D生成有机物P的反应类型是_______。
(2)有机物L的合成路线如下。
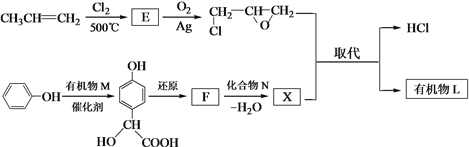
已知:![]()
① 生成E的化学方程式是_______。
② ![]() 与有机物M发生加成反应, M的结构简式为_______。
与有机物M发生加成反应, M的结构简式为_______。
③ F含羧基,化合物N是_______。
④ 生成有机物L的化学方程式是_______。
(3)以![]() 为起始原料合成聚合物甲的路线如下:
为起始原料合成聚合物甲的路线如下:
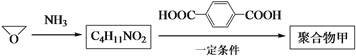
写出聚合物甲的结构简式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com