
分析 先求出ng该混合气体含有的分子数,再求出混合气体物质的量,最后根据标准状况下的气体摩尔体积求出体积.
解答 解:根据其组分及其含量相同,所以其质量与分子数成正比,设ng该混合气体含有的分子数为x个,
质量与分子数的比列式为:mg:b=ng:x,
x=$\frac{ng×b}{mg}$=$\frac{nb}{m}$个;
ng该混合气体含有的物质的量为:n=$\frac{N}{{N}_{A}}$=$\frac{\frac{nb}{m}}{{N}_{A}}$=$\frac{nb}{m{N}_{A}}$mol,
其体积为:V=n×Vm=$\frac{nb}{m{N}_{A}}$mol×22.4l/mol=$\frac{22.4nb}{m{N}_{A}}$L,
故答案为:$\frac{22.4nb}{m{N}_{A}}$.
点评 本题考查了物质的量、质量、气体摩尔体积之间的关系,题目难度不大,灵活运用公式是解题的关键,这种类型的题在高考选择题中经常出现.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
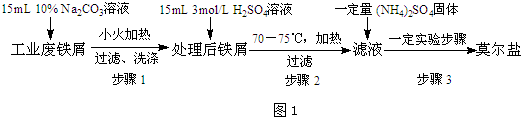
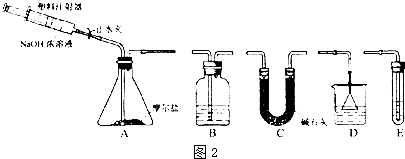
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
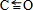 .NH3分子中N原子的杂化方式为sp3杂化,NH3分子的空间立体构型是三角锥形.
.NH3分子中N原子的杂化方式为sp3杂化,NH3分子的空间立体构型是三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于2cmol/L | B. | 小于2cmol/L | ||
| C. | 等于2cmol/L | D. | 在cmol/L和2cmol/L之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的pH=4 | |
| B. | 由HA电离出的c(H+)约为水电离出的c(H+)的106倍 | |
| C. | 在该温度下加水稀释,溶液中$\frac{c({H}^{+})}{c(HA)}$减小 | |
| D. | 此酸的电离平衡常数约为1.0×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含0.1NA个CO32-的Na2CO3固体的质量为10.6g | |
| B. | 含1mol HCl的盐酸与足量Fe反应,Fe失去的电子总数为2NA | |
| C. | 水的摩尔质量就是NA个水分子的质量之和 | |
| D. | 2mol氦气含有电子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 非金属性 | B. | 氢化物的稳定性 | ||
| C. | 单质熔点 | D. | 最高价氧化物对应水化物酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com