
| A. | CH4与P4的分子结构都是正四面体形,因此在6.02×1023个CH4分子或P4分子中都含有4×6.02×1023个共价键 | |
| B. | 在含6.02×1023个硅原子的二氧化硅晶体中含有4×6.02×1023个Si-O键 | |
| C. | 5.6 g Fe与含0.2 mol HNO3的溶液充分反应,至少失去0.2×6.02×1023个电子 | |
| D. | 6.02×1023个Fe3+完全水解可以得到6.02×1023个氢氧化铁胶体粒子 |
分析 A、甲烷中含4条C-H键,而白磷中含6条p-p键;
B、含6.02×1023个硅原子的二氧化硅晶体的物质的量为1mol,而1mol二氧化硅中含4molSi-O键;
C、5.6g铁的物质的量为0.1mol,0.1mol铁与0.2mol硝酸反应,无论硝酸是浓还是稀,铁均过量,据此分析.
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、甲烷中含4条C-H键,而白磷中含6条p-p键,故6.02×1023个CH4分子中含4molC-H键,即4NA个;6.02×1023个P4分子中含6molp-p键,即6NA个,故A错误;
B、1mol二氧化硅含1mol硅原子,故含6.02×1023个硅原子的二氧化硅晶体的物质的量为1mol,而1mol二氧化硅中含4molSi-O键,即4NA条,故B正确;
C、5.6g铁的物质的量为0.1mol,0.1mol铁与0.2mol硝酸反应,无论硝酸是浓还是稀,铁均过量,故反应后铁变为+2价,由于铁过量,故失去的电子小于0.2NA个,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故得到的氢氧化铁胶粒小于NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | CO2+H2O═H2CO3 | ||
| C. | Fe+H2SO4=FeSO4+H2↑ | D. | MgCO3+2HCl═2HCl2+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| X | 第三周期元素的简单离子中半径最小 |
| Y | 其最简单氢化物丙的水溶液呈碱性 |
| Z | 原子核外电子数和周期序数相等 |

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
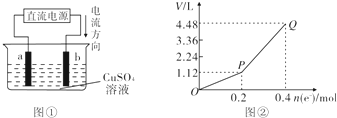 用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).
用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2通过Na2O2使其增重ag时,反应中转移电子数为$\frac{a{N}_{A}}{14}$ | |
| B. | 将1molCl2通入水中,则 N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| C. | 2.24L的CH4中含有的C-H键数为0.4NA | |
| D. | 常温常压下,3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阿伏加德罗常数的数值与12g 12C所含的碳原子数相等 | |
| B. | 在0.5mol Na2SO4 中,含有的Na+ 数约是6.02×1023 | |
| C. | 等物质的量的O2 与O3,所含氧原子数相等 | |
| D. | 摩尔是物质的量的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Va=Vb | B. | Va>Vb | C. | Va<Vb | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com