
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
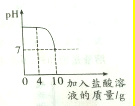 实验室有一瓶标签被腐蚀的盐酸,小丽为了测得溶液中溶质的质量分数,在烧杯中配制了8g 10%的NaOH溶液,然后往烧杯中滴加该盐酸,反应过程中溶液的pH与滴入盐酸的质量关系如图所示,请回答下列问题:
实验室有一瓶标签被腐蚀的盐酸,小丽为了测得溶液中溶质的质量分数,在烧杯中配制了8g 10%的NaOH溶液,然后往烧杯中滴加该盐酸,反应过程中溶液的pH与滴入盐酸的质量关系如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7 kJ/mol | ||
B、N2H4(g)+NO2(g)=
| ||
C、N2H4(g)+NO2(g)=
| ||
| D、2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=+1135.7 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、任何晶体中,若含有阳离子也一定含有阴离子 |
| B、金属键越强,则该金属的金属性越强 |
| C、将铁制品做成炊具,金属键没有被破坏 |
| D、金属导电的过程实质上就是金属键被破坏的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、棉花、木材及草类的纤维都属于天然纤维 |
| B、所有分散系的分散质粒子都能透过半透膜 |
| C、16O与18O互为同素异形体 |
| D、H2、D2、T2互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①AgNO3 ②NaBr ③AgBr |
| B、①AgNO3 ②NaCl ③AgCl |
| C、①AgCl ②AgNO3 ③NaCl |
| D、①AgNO3 ②NaI ③AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol | B、3mol |
| C、64g | D、32g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com