
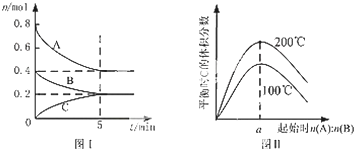
| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.02 mol•L-1•min-1 | |
| B. | 图Ⅱ所知反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 | |
| C. | 若在图Ⅰ所示的平衡状态下,再向体系中充入0.2molB和0.2molC,重新达到平衡前v(正)>v(逆) | |
| D. | 在200℃时,向容器中充入2mol A 和1mol B,达到平衡时,A 的体积分数大于0.5 |
分析 A.由图Ⅰ可知,200℃时平衡时,B的物质的量变化量为0.4mol-0.2mol,根据v=$\frac{△c}{△t}$计算v(B);
B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,据此判断反应热效应;在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,由图Ⅰ判断200℃时A、B的起始物质的量,据此计算a的值;
C.根据图Ⅰ中A、B、C的物质的量变化量之比等于化学计量数之比确定x、y、z,计算200℃时,再向体系中充入0.2molB和0.2molC时的浓度商与化学平衡常数大小,判断化学平衡移动方向,得到答案;
D.200℃时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,根据图Ⅰ中A、B、C的物质的量变化量之比等于化学计量数之比确定x、y、z,据此判断增大压强平衡移动方向.
解答 解:A.由图Ⅰ可知,200℃时5min达到平衡,平衡时B的物质的量变化量为0.4mol-0.2mol=0.2mol,故v(B)=$\frac{\frac{0.2mol}{2L}}{5min}$=0.02 mol•L-1•min-1,故A正确;
B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即△H>0,图Ⅰ可知,200℃时平衡时,A的物质的量变化量为0.8mol-0.4mol=0.4mol,B的物质的量变化量为0.2mol,在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,A、B的起始物质的量之比=0.4mol:0.2mol=2,故B错误;
C.由图Ⅰ可知,200℃时平衡时,A、B、C的物质的量变化量分别为0.4mol、0.2mol、0.2mol,物质的量之比等于化学计量数之比,故x:y:z=0.4mol:0.2mol:0.2mol=2:1:1,平衡时A、B、C浓度分别为:0.2mol/L、0.1mol/L、0.1mol/L,化学平衡常数K=$\frac{0.1}{0.2{\;}^{2}×0.1}$=25,加入0.2molB和0.2molC后,浓度分别为:0.2mol/L、0.1+0.1=0.2mol/L、0.1+0.1=0.2mol/L,浓度商为:$\frac{0.2}{0.2{\;}^{2}×0.2}$=25,刚好处于化学平衡状态,故v(正)=v(逆),故C错误;
D.由图Ⅰ可知,200℃时平衡时,A、B、C的物质的量变化量分别为0.4mol、0.2mol、0.2mol,物质的量之比等于化学计量数之比,故x:y;z=0.4mol:0.2mol:0.2mol=2:1:1,平衡时A 的体积分数为$\frac{0.4mol}{0.4mol+0.2mol+0.2m0l}$=0.5,200℃时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,平衡向正反应移动,A的增大,故达到平衡时,A 的体积分数小于0.5,故D错误;
故选A.
点评 本题考查化学平衡图象、反应速率计算、影响化学平衡的因素、化学平衡有关计算等,难度中等,注意B选项中理解稀有气体对化学平衡移动的影响.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯(苯酚):加NaOH溶液,充分振荡,分液,留下层液体 | |
| B. | 乙醇(乙醛):加新制Cu(OH)2溶液,加热至沸腾,过滤取溶液即可 | |
| C. | 乙烷(乙烯):通过盛有足量酸性高锰酸钾溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,留上层液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢氧化钠溶液 | B. | 碳酸钠溶液 | C. | 浓硫酸 | D. | 饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇.
氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液可以用于区分葡萄糖和麦芽糖 | |
| B. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| C. | 对苯二酚和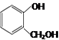 互为同系物 互为同系物 | |
| D. | 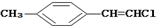 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
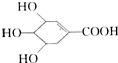 八角、茴香中含有一种抗亚川禽流感病毒的重要成分莽草酸,它的结构简式如图:下列关于莽草酸的说法中正确的是( )
八角、茴香中含有一种抗亚川禽流感病毒的重要成分莽草酸,它的结构简式如图:下列关于莽草酸的说法中正确的是( )| A. | 该化合物的分子中处于同一平面的原子只有4个 | |
| B. | 该化合物能发生消去反应,不能发生酯化反应 | |
| C. | 该化合物属于多元醇类物质,不能使溴水褪色 | |
| D. | 该化合物只有酸性,不具有碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | ||
| C. | c(NH4+)<c(Cl-)<c(H+)<c(OH-) | D. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com