
ij��ɫ����Һ�п��ܴ�������Ag����Mg2����Cu2���еļ������ӡ�
��1�������κ�ʵ��Ϳ��Կ϶�ԭ��Һ�в����ڵ�������_________�������� ��
��2��ȡ����ԭ��Һ�������ϡ���ᣬ�а�ɫ�������ɣ��ټ������ϡ���ᣬ��ɫ��������ʧ��˵��ԭ��Һ�п϶��е�������________���йص����ӷ���ʽΪ_____________��
��3��ȡ��2������Һ�������NaOH��Һ�����ְ�ɫ������˵��ԭ��Һ�п϶����ڵ�������_________���йط�Ӧ�����ӷ���ʽΪ ��
��4��ԭ��Һ�п��ܴ������ڵ�������������A��D�еģ�����ţ�_________��
A��Cl�� B��NO3�� C��CO32�� D��OH��
 �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�������������ʦ���и߶��Ͽ�ѧ����ѧ���������棩 ���ͣ�ѡ����
ij��ȤС�������ͼ��ʾʵ��װ�ã�ʵ��ʱ�ȶϿ�K2���պ�K1�������������ݲ�����һ��ʱ��Ͽ�K1���պ�K2�����ֵ�����Aָ��ƫת�������й�������ȷ����
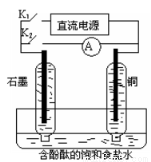
A���Ͽ�K2���պ�K1ʱ����Ӧ�����ӷ���ʽΪ��2H+ + 2Cl����Cl2��+H2��
B���Ͽ�K2���պ�K1ʱ��ʯī�缫������Һ���
C���Ͽ�K1���պ�K2ʱ��ͭ�缫�ϵĵ缫��ӦΪ�� Cl2+2e����2Cl��
D���Ͽ�K1���պ�K2ʱ��ʯī�缫������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ����8���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
ij��ѧ��ȤС��������ͼװ���Ʊ��������������۲�����ɫ���ṩ��ѧҩƷ����м��ϡ���ᡢ����������Һ��
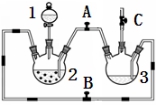
��1��ϡ����Ӧ���� �У���д�������ƣ���
��2����ʵ��ͨ������A��B��C�������أ��������еĿ����ž����ٹرտ��� ������ �Ϳɹ۲쵽��������������ɫ���Է���ʵ�鿪ʼʱ�ž�װ���п���������
��3��ʵ��ʱΪ��ֹ����2������ͨ�����ܽ�������3�У��ɲ�ȡ�Ĵ�ʩ�� ��
��4����FeSO4��Һ�м��루NH4��2SO4������Ʊ�Ħ���ξ���[��NH4��2SO4��FeSO4��6H2O] ����Է�������392�����þ����һ���������ȶ������ױ�������������ˮ���������Ҵ���
��Ϊϴ�ӣ�NH4��2SO4��FeSO4��6H2O�ֲ�Ʒ�����з���������ʵ���
A������ˮϴ B��������ˮϴ��������ˮ�Ҵ�ϴ
C����30%���Ҵ���Һϴ D����90%���Ҵ���Һϴ
��Ϊ�˲ⶨ��Ʒ�Ĵ��ȣ���ȡa g��Ʒ����ˮ�����Ƴ�500mL��Һ����Ũ��Ϊc mol��L-1������KMnO4��Һ�ζ���ÿ����ȡ����Һ�����Ϊ25��00mL��ʵ������¼���£�
ʵ����� | ��һ�� | �ڶ����� | ������ |
���ĸ��������Һ���/mL | 25��52[ | 25��02 | 24��98 |
�ζ������з�����Ӧ�����ӷ���ʽΪ
�ζ��յ��������
ͨ��ʵ�����ݼ���ĸò�Ʒ����Ϊ ������ĸac��ʾ�����ϱ��е�һ��ʵ���м�¼�������Դ��ں����Σ���ԭ�������
A��ʵ�����ʱ���ӿ̶��߶�ȡ�ζ��յ�ʱ���Ը��������Һ�����
B���ζ�ǰ�ζ��ܼ��������ݣ��ζ�����������
C����һ�εζ��õ���ƿ�ô�װҺ��ϴ����������δ��ϴ
D�������Ը�����ر�Һ����ʱ��������в��ֱ��ʣ�Ũ�Ƚ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ����8���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ���������ɻ�ʵ����ۺ������ǣ� ��
A��֤��һƿ����ɫ���������������Ƕ�������������ʪ��ĵ⻯�أ�������ֽ���飬�۲���ֽ��ɫ�ı仯
B�����ȼ���������ϡ�����ٵμ�KSCN��Һ��δ����Ѫ��ɫ�����ȼ���һ����������������
C������ˮ��pH�����ò�����պȡ��ˮ����pH��ֽ�ϣ������ɫ��ͱ���ɫ���Ƚ�
D����Ũ�������ն��������л�������SO3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ����8���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й����ʵ�������Ӧ�����Ӧ���ǣ� ��
A���������̾���ǿ�����ԣ�������H2O2�ֽ��������
B��K2FeO4���л�ԭ�ԣ�����������ˮ��ɱ������
C��Ũ�����ڳ�������ʹ���ۻ����������۳�����Ũ����
D��SO2����Ư���ԣ���ʹ��ɫKMnO4��Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��㶫ʡ�����и���8���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ˮ��Һ���ܴ��������һ�������ǣ� ��
A��Al3+��Na+��HCO3����OH�� B��H+��Fe2+��ClO����Cl��
C��Mg2+��K+��SO42?��NO3�� D��NH4+ Ag+��OH����Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ɽ��ʡЭ���������ٵ�һ��������ѧ�Ծ��������棩 ���ͣ������
����ԭCO2�ǽ������ЧӦ����Դ�������Ҫ�ֶ�֮һ���о���������Cu/ZnO���������£�CO2��H2�ɷ�������ƽ�ⷴӦ���ֱ�����CH3OH��CO����Ӧ���Ȼ�ѧ����ʽ���£�
CO2��g��+3 H2��g�� CH3OH��g��+H2O��g����H1=-53.7kJ��mol-1 I
CH3OH��g��+H2O��g����H1=-53.7kJ��mol-1 I
CO2��g��+ H2��g�� CO��g��+H2O��g����H2 II
CO��g��+H2O��g����H2 II
ijʵ���ҿ���CO2��H2��ʼͶ�ϱ�Ϊ1:2.2��������ͬ��Ӧʱ��������ʵ�����ݣ�
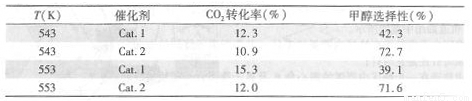
����ע��Cat.1:Cu/ZnO���װ���Cat.2:Cu/ZnO����Ƭ���״�ѡ���ԣ�ת����CO2�����ɼ�ȩ�İٷֱ�
��֪����CO��H2�ı�ȼ���ȷֱ�Ϊ-283.0kJ��mol-1��-285.8kJ��mol-1
��H2O��l�� H2O��g�� ��H3=44.0kJ��mol-1
H2O��g�� ��H3=44.0kJ��mol-1
��ش𣨲������¶ȶԦ�H��Ӱ�죩��
��1����ӦI��ƽ�ⳣ������ʽK= ����ӦII�Ħ�H2= kJ��mol-1��
��2�����������CO2ת��ΪCH3OHƽ��ת���ʵĴ�ʩ�� ��
A��ʹ�ô���Cat.1
B��ʹ�ô���Cat.2
C�����ͷ�Ӧ�¶�
D��Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ��
E������CO2��H2�ij�ʼͶ�ϱ�
��3������ʵ�����ݱ���������ͬ�¶��²�ͬ�Ĵ�����CO2ת����CH3OH��ѡ������������Ӱ�죬��ԭ���� ��
��4������ͼ�зֱ�I����������Cat.1����Cat.2��������¡���Ӧ����-������ʾ��ͼ��

��5���о�֤ʵ��CO2Ҳ��������ˮ��Һ��ͨ��������ɼ״��������ɼ״��ķ�Ӧ������___ �����õ缫��Ӧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ����8���¿���ѧ�Ծ��������棩 ���ͣ������
��ͼ��ʾΪһ����AlCl3��Һ�м���NaOH��Һ����Al(OH)3��ɫ������������NaOH�����ʵ���֮��Ĺ�ϵ���ߡ�
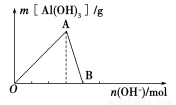
��ش��������⣺
��1��A��ʱ�Ѳμӷ�Ӧ��AlCl3��NaOH�����ʵ���֮��Ϊ________��
��2��AB����������ʾ�ķ�Ӧ�����ӷ���ʽΪ_________________________��
��3����B�����ɵ���Һ��ͨ�������̼���ɹ۲쵽��������_______________________��
��4������0.1 mol NH4Al(SO4)2����Һ����μ���5 mol��L��1 NaOH��Һ����ʼ������Һ�г��ְ�ɫ�����������ࣻһ��ʱ����д̼�����ζ�������ݳ�������ɫ�������ٲ�������ʧ��������ͼ�л������ɳ��������ʵ��������NaOH��Һ����Ĺ�ϵʾ��ͼ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ�����и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����������£��ܴ���������������ǣ� ��
A��c(H+)=1��10-14mol/L����Һ�� K����Cu2����I����SO42��
B��ˮ�������c(H+)=1��10-14mol/L����Һ��K+��Na����AlO2����S2O32��
C������Al��Ӧ����H2����Һ��NH4����Ca2+��NO3����I��
D������K3[Fe(CN)6]������ɫ��������Һ��H����Na����SO42����CrO42��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com