
 以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:分析 (1)由阴离子移动方向可知B为负极,负极发生氧化反应,甲烷被氧化生成二氧化碳和水;
(2)开始阶段发生反应:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒列方程计算,再根据电子转移守恒计算消耗的甲烷;根据电池中的能量转化率分析.
解答 解:(1)由阴离子移动方向可知B为负极,负极发生氧化反应,甲烷被氧化生成二氧化碳和水,电极方程式为CH4+4O2--8e-=CO2+2H2O,
故答案为:CH4+4O2--8e-=CO2+2H2O;
(2)硫酸铜的物质的量=0.1L×2mol/L=0.2mol,开始阶段发生反应:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒,则:0.1mol×2+2x=4x,解得x=0.1,
根据电子转移守恒,可知消耗的甲烷物质的量=$\frac{0.1mol×4}{8}$=0.05mol,故消耗甲烷的体积=0.05mol×22.4L/mol=1.12L,
故答案为:1.12 L.
点评 本题综合考查电化学知识,为高频考点,侧重于学生的分析、计算能力的考查,解答本题要注意把握原电池的工作原理,把握电极方程式的书写,题目难度中等.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:多选题
| A. | H2O | B. | CuO | C. | Cu(OH)2 | D. | CuCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、ClO-、Cl2三种微粒只具有氧化性,没有还原性 | |
| B. | Cl2具有强氧化性,可以把水中的氧置换出来 | |
| C. | 因为SO2具有还原性,所以与氯水可以反应生成H2SO4和HCl | |
| D. | Cl2转变为HClO时一定需要加入氧化剂才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
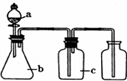 如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( )
如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( ) | 选项 | 气体 | a | b | c |
| A | H2 | 稀硫酸 | 锌粒 | 浓硫酸 |
| B | Cl2 | 浓盐酸 | 高锰酸钾 | 浓硫酸 |
| C | C2H2 | 饱和食盐水 | 电石 | 硫酸铜溶液 |
| D | O2 | 过氧化氢溶液 | 二氧化锰 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| B. | 纤维素在人体内可以水解为葡萄糖,故可作人类的营养物质 | |
| C. | 用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+ | |
| D. | “地沟油”禁止食用,但可以用来做肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象 | |
| B. | 取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象 | |
| C. | 取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化 | |
| D. | 取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液观察现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com