
【题目】短周期主族元素W、X、Y、Z、R的原子序数依次增大,A、B、C、D、E、F均是由上述元素组成的中学化学常见物质,其中A是四元化合物,C是能使湿润红色石蕊试纸变蓝的气体,D具有漂白性,E是单质。各物质之间存在如图转化关系(部分产物未标出)。下列说法不正确的是( )

A. 简单离子半径大小关系:Y>Z>RB. 简单阴离子的还原性:W>Y>Z
C. 氢化物的沸点:Z>Y>XD. C和E反应生成F是工业制硝酸的重要反应之一
【答案】C
【解析】
A、B、C、D、E、F均是由上述元素组成的中学化学常见物质,A是四元化合物,A与碱反应产生的 气体C能使湿润红色石蕊试纸变蓝,则该气体是NH3,A 是铵盐,A与酸反应产生B,B与具有漂白性的物质D反应产生单质E,则可推知B是CO2,D是Na2O2,E是O2,E与NH3在催化剂存在时,在加热条件下发生氧化还原反应,产生NO和水,则F是NO,A可能是酸式盐NH4HCO3,也可能是(NH4)2CO3。根据推断的物质的组成元素W、X、Y、Z、R都是短周期主族元素,原子序数依次增大,可推知W是H元素,X是C元素,Y是N元素,Z是O元素,R是Na元素,据此分析解答。
根据上述分析可知:W是H元素,X是C元素,Y是N元素,Z是O元素,R是Na元素。
A.Y、Z、R分别是N、O、Na元素,它们形成的离子电子层结构相同,离子的核电荷数越大,离子半径越小,所以简单离子半径大小关系:Y>Z>R,A正确;
B.W、Y、Z分别是H、N、O元素,元素的非金属性越强,其简单阴离子的还原性就越弱,这三种元素的非金属性Z>Y>W,所以简单离子的还原性强弱顺序是W>Y>Z,B正确;
C.X、Y、Z分别是C、N、O元素,三种元素的简单氢化物中,H2O是液体,CH4、NH3是气体,所以水的沸点最高,由于在NH3的分子之间除存在分子间作用力外,还存在氢键,增加了分子之间的吸引力,所以沸点比甲烷的高,故简单的氢化物的沸点:Z>Y>X,但C元素可以形成其它氢化物,如苯就呈液体,所以氢化物的沸点的大小关系不一定是上述关系,C错误;
D.C 是NH3,E是O2,在催化剂存在时,氨气可以被氧气氧化,反应方程式是:4NH3+5O2![]() 4NO+6H2O,反应产生的NO被氧化产生NO2,NO2被水吸收得到硝酸,因此C和E反应生成F是工业生产硝酸的重要反应之一,D正确;
4NO+6H2O,反应产生的NO被氧化产生NO2,NO2被水吸收得到硝酸,因此C和E反应生成F是工业生产硝酸的重要反应之一,D正确;
故合理选项是C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,错误的是( )
A.Fe(OH)3胶体常用来净水
B.“血液透析”利用了胶体的性质
C.光束通过硫酸铜溶液可看到丁达尔现象
D.胶体与溶液的本质区别是分散质粒子直径的大小不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸中二氧化硫的催化氧化原理为:2SO2(g)+O2(g)![]() 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是

A. 在A、B、C三点时,V(正)=v(逆),在D点时V(正)>v(逆)
B. A、B、C三点的平衡常数一定不相同
C. 升高温度可以加快化学反应速率,有利于平衡向正反应方向移动
D. 一定温度下,保持容器体积不变,向平衡体系中通人稀有气体,压强增大,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向下列溶液中通入适量SO2,能产生白色沉淀的是( )
A. BaCl2溶液 B. NaOH溶液 C. H2S饱和溶液 D. 酸化的Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
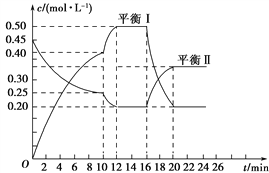
(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是______________________;第16min引起曲线变化的反应条件可能是________________________。
①减压 ②增大A的浓度 ③增大C的量 ④升温⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成阳离子、阴离子个数比为2:1的离子化合物丙.
(1)B的气态氢化物的电子式为_____________,请用电子式表示A与C形成化合物的过程____________。
(2)E在周期表中的位置为______________________。
(3)下列说法正确的有_________。
①化合物乙分子中只含有极性共价键
②化合物甲和化合物丙都含有离子键和共价键
③B、E分别与A形成的简单化合物中,B的更稳定
④C、D、E、F原子半径由大到小的顺序为C>D>E>F
(4)写出由以上元素构成的10电子分子与18电子分子按物质的量之比1:1反应生成盐的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】米力农是一种用于治疗慢性心衰竭的化合物。某研究小组按下列路线合成米力农.
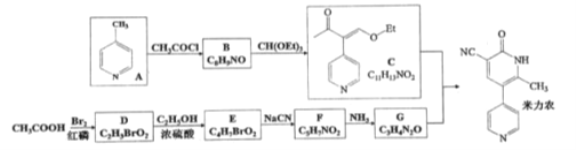
已知: ①化合物B中只含一个甲基。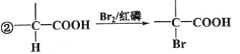 。请回答下列问题:
。请回答下列问题:
(1)化合物B的结构简式是 ________________
(2)下列说法不正确的是____________
A.CH(OEt)3的化学式为 C7H16O3
B.C+G → 米力农的反应类型为加成反应
C.上图D→ E→ F的合成路线,避免毒性极强HCN的生成
D.化合物D中滴加AgNO3溶液,会有淡黄色沉淀生成
(3)写出F→ G的化学方程式 _________________________________
(4)化合物A经充分加氢,可得化学式为C6H13N的化合物X,X有多种结构,请写出符合下列条件的X的同分异构体的结构简式__________。
①含有一个五元环;②1H —NMR谱中只有4种峰。
(5)写出以乙酸为原料制备![]() 的合成路线(用流程图表示,无机试剂任选)__________。
的合成路线(用流程图表示,无机试剂任选)__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com