
【题目】我国科学家研制出“可充室温Na-CO2电池”(Rechargeable Room-Temperature Na-CO2 Batter-ies)现已取得突破性进展,其有望取代即将“枯竭”的锂电池,该电池结构如图所示。下列说法错误的是
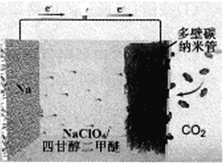
A. 电池工作时,正极发生反应:4Na++3CO2+4e-==2Na2CO3+C
B. 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.46 g
C. 多壁碳纳米管的作用主要是导电及吸附CO2
D. 电池中四甘醇二甲醚可用饱和食盐水代替实现Na+传导
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)除去自来水中的Ca2+、Mg2+、Cl—、SO42—等杂质,选择装置_____________(填代表装置图的字母)。
(2)用CCl4萃取碘水中的I2,有机层的颜色为___________________。
(3)装置A中①的名称是_____________,进水的方向是_____________。装置B在分液时为使液体顺利滴下,应进行的具体操作是_____________。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:

问题1:粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。
正确的操作顺序是_____________(填写字母)。
a.⑤②③①⑥④⑦b.⑤①②③⑥④⑦ c.⑤③②①⑥④⑦d.⑤②①③④⑥⑦
问题2:由海水到氯化钠晶体的实验过程中要用到的主要装置是_____________(从给定的四种装置中选择,填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于有机物![]() 的叙述正确的是
的叙述正确的是
A. 在一定条件下1mol该物质最多与4molH2发生加成反应
B. 该物质不能与碳酸氢钠反应放出二氧化碳
C. lmol该物质与足量的金属钠反应生成2molH2
D. 该物质含羟基与苯环直接相连的结构且能水解的同分异构体有19种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁是一种具有芳香族性质的有机过渡金属化合物。二茂铁熔点是173℃,在100℃时开始升华,沸点是249℃,不溶于水,易溶于苯、乙醚、汽油、柴油等有机溶剂;化学性质稳定,400℃以内不分解。实验室制备二茂铁装置示意图如下图,实验步骤为:

①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a 中加入60mL 无水乙醚到三颈烧瓶中,充分搅拌,同时通氮气约10min;
②再从仪器a 滴入5.5 mL 新蒸馏的环戊二烯(C5H6、密度0.95g/cm3),搅拌;
③将6.5g 无水FeCl2 与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25ml 装入仪器a中,慢慢滴入三颈烧瓶中,45min 滴完,继续搅拌45min;
④再从仪器a 加入25mL 无水乙醚搅拌;
⑤将三颈烧瓶中液体转入分液漏斗,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器b 的名称是__________________,作用是_____________________。
(2)步骤①中通入氮气的目的是_____________________。
(3)三颈烧瓶的适宜容积应为__________ (填序号);①100ml、②250ml、③500ml;步骤⑤所得的橙黄色溶液的溶剂是_____________________。
(4)KOH、FeCl2、C5H 6反应生成二茂铁[Fe(C5H5)2]和KCl 的化学方程式为_____________________。
(5)二茂铁粗产品的提纯过程在上图中进行,其操作名称为________________。二茂铁及其衍生物可做抗震剂用于制无铅汽油,它们比曾经使用过的四乙基铅安全得多,其中一个重要的原因是_________________________________。
(6)最终得到纯净的二茂铁4.8g,则该实验的产率为___________________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下将VLHCl溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为w,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A. ρ=(36.5V+22400)/(22.4+22.4V) B. ω=36.5c/(1000ρ)
C. ω=36.5V/(36.5V+22400) D. c=1000Vρ/(36.5V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g) + 3H2(g)![]() 2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是
2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是

A.X表示温度
B.L2>L1
C.反应速率 υ(M)>υ(N)
D.平衡常数 K(M)>K(N)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是
A.分离溴苯与苯:用分液漏斗分液
B.萃取溴水中的溴:向溴水中加入己烷
C.制硝基苯:将苯、浓硝酸、浓硫酸的混合液用酒精灯加热
D.制取溴苯:将铁屑、溴水、苯混合加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 摩尔是物质的量的单位
B. 溶液中或熔融状态下能导电的物质就是电解质
C. 氧化还原反应的本质是元素化合价发生了变化
D. 得电子的物质被还原,是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行了探究。己知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是_______(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示);根据反应③判断△S_______(填“>”“=”或“<”)0,在_______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有______(填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g的浓度分别为 0.1mol/L、0.8 mol/L、0.3 mol/L、0.15 mol/L,则此时v(正)_______v(逆) (填“>”“=”或“<”)。
(5)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升高温度,t1时平衡,t2时减小压强,t3时增大CO的浓度,t4时又达到平衡。在下图中画出t2至t4的曲线。_____

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com