
【题目】现代传感信息技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(如图1所示),并测定电离平衡常数Kb。
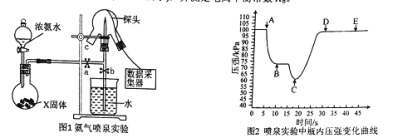
(1)实验室可用浓氨水和X固体制取NH3 , X固体可以是 。
A.生石灰 B.无水氯化钙 C.五氧化二磷 D.碱石灰
(2)检验三颈瓶集满NH3的方法是: 。
(3)关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c口, ,引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图2所示。图2中 点时喷泉最剧烈。
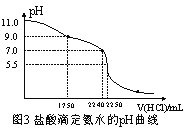
(4)从三颈瓶中用 (填仪器名称)量取20.00 mL氨水至锥形瓶中,用 0.05000 mol/L HCl滴定。用pH计采集数据、电脑绘制滴定曲线如图3所示。
(5)据图3计算,当pH =11. 0 时,NH3H2O电离平衡常数Kb的近似值,Kb≈ 。
【答案】(1)AD (2分) (2)将湿润的红色石蕊试纸靠近瓶口c,试纸变蓝色,证明NH3已收满。(2分)或将蘸有浓盐酸的玻璃棒靠近瓶口c,有白烟生成,证明NH3已收满。
(3)打开b,挤压胶头滴管使水进入烧瓶 (2分) C (1分)
(4)碱式滴定管(或20 mL移液管)(1分) (5)1.8×105 (2分)
【解析】
试题分析:(1)氨水中存在平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,因此利用氨水制备氨气,可以加入的固体是氧化钙或氢氧化钠或碱石灰,答案选AD。
NH4++OH-,因此利用氨水制备氨气,可以加入的固体是氧化钙或氢氧化钠或碱石灰,答案选AD。
(2)检验氨气通常用湿润的红色石蕊试纸,检验三颈瓶集满NH3的操作是:将湿润的红色石蕊试纸靠近瓶口c,试纸变蓝色,证明NH3已收满。
(3)根据装置图引发喷泉实验的操作是:可知关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c口,打开b,挤压胶头滴管使水进入烧瓶,引发喷泉实验;进行喷泉实验时在瓶内压强最小的时候最剧烈,从图2中看出C点压强最小,故C点最激烈。
(4)准确量取液体可以用滴定管或移液管,氨水显碱性,故可用碱式滴定管或移液管。
(5)从图中看出,盐酸体积在22.50mL时发生突变,则氨水的浓度为:c(NH3·H2O)×20.00=0.0500 molL-1×22.50,得c(NH3·H2O)= 0.05625molL-1;NH3H2O电离平衡常数Kb的表达式,Kb= c(NH4+)×c(OH-)/c(NH3·H2O;pH=11.0时,c(NH4+)≈c(OH-)=10-3 molL-1,c(NH3·H2O) ≈0.05625 molL-1,,Kb= c(NH4+)×c(OH-)/c(NH3·H2O=10-6/0.5625≈2.2×10-5。


科目:高中化学 来源: 题型:
【题目】溴和碘的化合物在生产和生活中有广泛的用途.
(1)市场销售的某种食用精制盐中含碘酸钾。
①碘酸钾与碘化钾在酸性条件下发生如下反应,配平该反应的化学方程式:
![]()
②上述反应生成的I2可用四氯化碳检验,现象为________________________。
向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
Na2SO3稀溶液与I2反应的离子方程式是________________________。
(2)海水提溴过程中溴元素的变化如下:
![]()
①过程I,海水显碱性,调其pH<3.5后,再通入氯气,调节海水pH可提高C12的利用率,用平衡原理解释其原因是_______________________。
②过程II,用热空气将溴赶出,再用浓Na2CO3溶液吸收。完成并配平下列方程式。
![]()
③过程III,用硫酸酸化可得Br2和Na2SO4的混合溶液。相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是_________________________。
④NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入 2.6molNaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
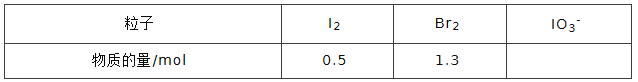
则原溶液中NaI的物质的量为_________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中A与B反应生成C,其反应速率分别用v (A)、v (B)、v (C)表示。已知v (A)、v (B)、v (C)之间有以下关系2 v (B)=3 v (A), 3 v (C)=2 v (B)。 则此反应可表示为( )
A. 2A + 3B = 2C B. A+ 3B = 2C
C. 3A + B = 2C D. A + B = C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是
A.用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑
D.一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:
2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 在化学反应过程中,发生物质变化的同时不一定发生能量变化
B. 破坏生成物全部化学健所需要的能量大于破坏反应物全部化学键所需要的能量时,该反应为吸热反应
C. 生成物的总焓大于反应物的总焓时,反应吸热,△H>0
D. △H的大小与热化学方程式的化学计量数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量极少,且必不可少的化学元素是
A. Fe Mn Zn Mg B. Zn Cu Mn Ca C. H O Na Mg D. Zn Cu B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图所示(反应条件和部分产物略去)。下列说法中不正确的是
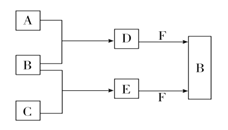
A.F中阴阳离子个数比为1:1
B.化合物F中既有离子键又有共价键
C.合成过程中的反应均是氧化还原反应
D.1mol F与E反应时转移的电子数为NA(NA为阿伏伽德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素的原子序数依次增大。A是元素周期表中原子半径最小的元素;B元素的原子最外层电子数是次外层电子数的2倍;D与A能形成两种原子个数比分别为1:1和1:2的共价化合物X和Y;D还能与E形成两种原子个数比分别为1:1和1:2的离子化合物M和N;F的最高正化合价为+6。
回答下列问题:
(1)C元素的化学名称为____________,F元素的化学名称为____________。
(2)Y的电子式为____________,M中阴离子的离子符号为___________。
(3)由以上六种元素中的两种原子构成的五核10e-分子的空间构型是______________。
(4)用电子式表示化合物E2F的形成过程为____________________。
(5)D、F的简单氢化物的沸点高低为____________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质结构的说法正确的是
A. 有强共价键存在的物质熔沸点一定很高
B. 液氯与水反应破坏了分子间作用力和共价键
C. 离子化合物中一定含有离子键、一定不含共价键
D. 晶体NH4Cl和Na2O中的化学键类型完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com