
 离子交换膜法电解食盐水的示意如图,图中离子交换膜只允许阳离子通过.下列说法正确的是( )
离子交换膜法电解食盐水的示意如图,图中离子交换膜只允许阳离子通过.下列说法正确的是( )| A. | e电极与电源的负极相连 | |
| B. | H+在f电极上发生还原反应 | |
| C. | 精制饱和食盐水从图中b位置补充 | |
| D. | 离子交换膜的作用只是防止生成的Cl2与H2发生反应 |
分析 电解饱和食盐水时,电解池阳极,发生:2Cl─-2e-=Cl2↑,阴极,发生2H++2e-=H2↑,电解的总反应:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;生成的氯气会和氢氧化钠之间反应得到氯化钠和次氯酸钠,但是加上阳离子交换膜可以避开这一反应,据此回答.
解答 解:A、电解饱和食盐水时,电解池阳极,发生:2Cl─-2e-=Cl2↑,阴极,发生2H++2e-=H2↑,产生Cl2的电极是阳极,即e电极与电源的正极相连,故A错误;
B、阴极,发生2H++2e-=H2↑,所以H+在f电极上发生还原反应,故B正确;
C、精制饱和食盐水从图中a位置补充,故C错误;
D、阳离子交换膜的作用是防止生成氯气和氢氧化钠之间反应得到氯化钠和次氯酸钠,故D错误.
故选B.
点评 本题以电解氯化钠为例来考查学生电解池的工作原理知识,注意知识的归纳和整理是关键,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
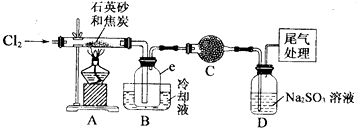
| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 315 | |
| 熔点/℃ | -70.0 | ||
| 升华温度/℃ | 180 | 300 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲可以判断出反应 A(g)+B(g)?2C(g) 的△H<0,T2>T1 | |
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 | |
| C. | 据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4.5 | |
| D. | 图丁表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入盐酸体积的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅熔点高硬度大,可用于制作半导体材料 | |
| B. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| C. | 二氧化硫具有氧化性,可用于漂白纸浆 | |
| D. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 2L 0.5mol•L-1亚硫酸溶液中含有的H+数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | X能使高锰酸钾酸性溶液褪色 | |
| C. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为 | |
| D. | X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)在实验室制取乙烯的装置图(如图)中,A中加入的两种试剂是浓硫酸和乙醇,它们的体积比约为3:1;反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;乙烯的收集方法为排水集气法;
(1)在实验室制取乙烯的装置图(如图)中,A中加入的两种试剂是浓硫酸和乙醇,它们的体积比约为3:1;反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;乙烯的收集方法为排水集气法;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com