
 某学生用0.100 0mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100 0mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 滴定 次数 | 盐酸溶液/mL | 0.100 0mol•L-1NaOH的体积(mL) | ||
| 滴定前 | 滴定 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
分析 (1)中和滴定操作有检漏、洗涤、润洗、装液、取待测液于锥形瓶,然后加入指示剂进行滴定等操作;
(2)滴定管需要润洗2-3次防止滴定管内壁附着的水将标准溶液稀释而带来误差;
(3)根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(5)根据滴定管的结构和精确度读出滴定管中的读数;
(6)先根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸),再根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$计算出c(NaOH).
解答 解:(1)操作的步骤是选择滴定管,然后洗涤、装液、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数,再取待测液于锥形瓶,然后加入指示剂进行滴定,所以正确的滴定顺序为:B、D、C、E、A、F,
故答案为:B、D、C、E、A、F;
(2)滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低,所以必须用标准溶液润洗滴定管2-3次,防止滴定管内壁附着的水将标准溶液稀释而带来误差,
故答案为:防止滴定管内壁附着的水将标准溶液稀释而带来误差;
(3)锥形瓶用蒸馏水洗涤后,如果再用待测液润洗,会使锥形瓶内的待测液中溶质的物质的量增大,会造成V(标准)偏大,根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$可知,测定结果偏高,
故答案为:偏高;
(4)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色,
故答案为:滴入最后一滴NaOH溶液,溶液由无色变为浅红色,且在半分钟内不褪色;
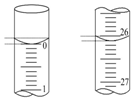
(3)酸式滴定管中的液面如图所示,起始读数为0.00mL,终点读数为26.10mL,
故答案为:0.00;26.10;
(6)根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸)=$\frac{26.11+26.09}{2}$mL=26.10mL,
根据反应方程式:HCl+NaOH=NaCl+H2O,n(HCl)=n(NaOH),即:0.0261L×0.1000mol/L=0.025L×c(NaOH),
解得:c(NaOH)=$\frac{0.0261L×0.1000mol/L}{0.025L}$=0.1044mol/L,
故答案为:0.1044mol/L.
点评 本题考查了中和滴定方法及误差分析,注意掌握中和滴定的操作方法,试题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:选择题
| A. | H2O | B. | Zn | C. | KCl | D. | KI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用加碘盐可预防碘缺乏症,加碘盐中加的含碘物质是碘单质 | |
| B. | 因为NaCl的水溶液能导电,所以NaCl溶液属于强电解质 | |
| C. | 电解熔融NaCl得到23.0g金属钠时能产生22.4 L氯气(标准状况下) | |
| D. | 37Cl 是氯元素的一种同位素,23Na37Cl中质子数和中子数之比是7:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度、压强下,一定数量的任何物质的体积由微粒间的平均距离所决定 | |
| B. | 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 | |
| C. | 根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等 | |
| D. | 强电解质溶液的导电能力一定强于弱电解质溶液的导电能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性P<S | |
| B. | H3PO4溶液的导电能力弱于H2SO4溶液 | |
| C. | Na3PO4溶液呈碱性,Na2SO4溶液呈中性 | |
| D. | H2SO4溶液与Na3PO4反应可以生成H3PO4和Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
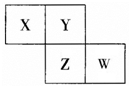 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3 个,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3 个,下列说法正确的是( )| A. | 氧化物对应水化物酸性W比Z强 | |
| B. | Y单质与Z的氢化物水溶液反应,有沉淀生成 | |
| C. | X单质氧化性强于Y单质 | |
| D. | 简单离子的半径:Z<W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com