
某工厂的废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
Ⅰ.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向Ⅰ所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤Ⅰ中发生反应的化学方程式为__________________、__________________。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因:__________。
(3)步骤Ⅲ获得CuSO4溶液的离子方程式为____________。
(4)步骤Ⅱ所得滤液经进一步处理可制得Na2FeO4,流程如下:

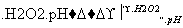
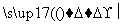
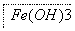
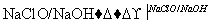
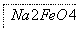
①测得滤液中c(Fe2+)为a mol·L-1,若要处理1 m3滤液,理论上需要消耗25%的H2O2溶液________kg(用含a的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式:_____________。
解析:本题考查了Cu、Fe、Al及其化合物的性质以及氧化还原反应、化学计算等,意在考查考生运用所学知识综合分析问题的能力。(1) Al和Al2O3均与NaOH溶液发生反应。(2)Ⅰ所得固体混合物中含有的单质铁和铜均可将Fe3+还原为Fe2+。(4)①H2O2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为2Fe2++H2O2+2H+===2H2O+2Fe3+,n(H2O2)=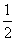 n(Fe2+)=
n(Fe2+)=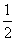 ×1000a mol=500a mol,m(H2O2)=500a mol×34 g·mol-1=17000a g,故需25%的H2O2溶液的质量为
×1000a mol=500a mol,m(H2O2)=500a mol×34 g·mol-1=17000a g,故需25%的H2O2溶液的质量为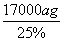 =68000a g=68a Kg。②根据化合价变化及氧化还原反应规律可知Fe(OH)3被氧化,而NaClO被还原为NaCl,然后根据得失电子守恒、原子守恒配平方程式即可。
=68000a g=68a Kg。②根据化合价变化及氧化还原反应规律可知Fe(OH)3被氧化,而NaClO被还原为NaCl,然后根据得失电子守恒、原子守恒配平方程式即可。
答案:(1)2Al+2H2O+2NaOH===2NaAlO2+3H2↑(2分) Al2O3+2NaOH===2NaAlO2+H2O(2分)
(2)2Fe3++Fe===3Fe2+(或2Fe3++Cu===2Fe2++Cu2+或Fe+Fe2O3+6H+===3Fe2++3H2O等)(1分)
(3)2Cu+O2+4H+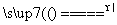 2Cu2++2H2O(2分)
2Cu2++2H2O(2分)
(4)①68a(2分) ②2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3NaCl+5H2O(2分)


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
等物质的量的A(g)与B(g)在密闭容器中进行反应:A(g)+B(g)2C(g)+D(s) ΔH<0,下列叙述正确的是( )
A.达到平衡后,反应速率v正(A)=2v逆(C)
B.达到平衡后,增大压强,平衡逆向移动
C.达到平衡后,升高温度,平衡正向移动
D.平衡常数K值越大,A的转化率越高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是 ( )
A.N2、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解
C.可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层
D.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.Cu(OH)2中加入硫酸:OH-+H+===H2O
B.钠加入水中:Na+2H2O===Na++2OH-+H2↑
C. FeSO2溶液中加入稀硝酸:3Fe2++4H++NO ===3Fe3++2H2O+NO↑
===3Fe3++2H2O+NO↑
D.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况)。向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是21
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式如右图所示,下列关于该物质的性质描述正确的是
 A.不能使溴的四氯化碳溶液褪色
A.不能使溴的四氯化碳溶液褪色
B.能发生缩聚反应
C.既能发生消去反应,也能发生取代反应
D.1 mol该物质最多可与5mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
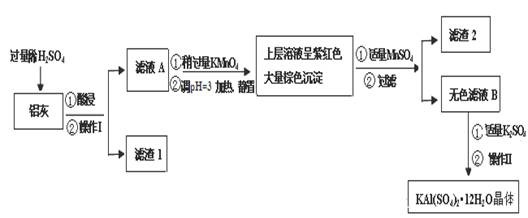 明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 干燥。
(3)检验滤液A中是否存在Fe2+的方法是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾的目的是 ,发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4- 转化为Mn2+) 。
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的 。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。加入MnS04发生反应的离子方程式为: 。滤渣2含有的物质是 。
(6)以Al和NiO(OH)为电极,KOH溶液为电解液可组成新型、高效电池,充放电过程中,发生Ni(OH)2与NiO(OH)之间的转化,写出放电时电池反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
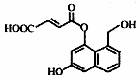
香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
 有关上述两种化合物的说法正确的是
有关上述两种化合物的说法正确的是
A.常温下,1mol丁香酚只能与1molBr2反应
B.丁香酚不能使FeCl3溶液发生显色反应
C.1mol香兰素最多能与3mol氢气发生加成反应
D.丁香酚和香兰素都可以使酸性KMnO4溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com