
【题目】在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g)![]() 2C(g),可以判断达到化学平衡状态的是
2C(g),可以判断达到化学平衡状态的是
A. 体系压强不变 B. A的浓度不变
C. 单位时间消耗mol A,同时生成2 nmol C D. 容器内气体密度不变
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)①氯胺(NH2Cl)的电子式为_______。
②工业上可利用Cl2和NH3反应制备氯胺,该反应的化学方程式为_______。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol·L-1 NaOH溶液充分反应放出的热量如下表所示:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | x |
2 | 1.0 | 2.00 | y |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为__________。
(3)用焦炭还原NO的反应为:2NO(g) + C(s) ![]() N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/ml | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
②该反应的ΔH___0 (填“>”或“<”)。
③丙容器达到平衡时,NO的转化率为___________。
(4)常温下,在NH4HCO3溶液中,c(NH4+)________c(HCO3-) (填“>”、“<”或“=”);反应NH4++HCO3-+H2O ![]() NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示实验装置测定常温常压下的气体摩尔体积。
根据下列步骤完成实验:
①装配好装置,检查气密性
②用砂纸擦去镁带表面的氧化物,然后取0.0480g的镁带加入仪器a中,分液漏斗内加入足量1mol/L硫酸溶液
③量气装置中加入适量水,记录量气管读数(读数为0.10mL)
④通过分液漏斗向仪器a中加入适量硫酸溶液,使镁带与硫酸充分反应
⑤当镁带完全反应后,再次记录量气管读数(读数为49.60mL)。

完成下列填空:
(1)仪器a的名称_______,通过分液漏斗向仪器a中加入硫酸溶液的操作是_______。
(2)在记录量气管读数时,应注意将_______,再________,视线与量气管内凹液面相切,水平读数。
(3)该同学测出此条件下气体摩尔体积为__________,测定结果比理论值偏大,可能的原因是(填字母代号)__________。
a.镁带中氧化膜未除尽 b.镁带含有杂质铝
c.③记录量气管读数时俯视读数 d.镁带完全反应后有残留的未溶固体
(4)与原方案装置相比,有同学设想用装置B代替装置A,实验精确度更高。请说明理由____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸可与水反应生成乳酸,化学方程式如下,下列说法正确的是

A. 该反应为加成反应,没有副产物生成
B. 可用Br2/CCl4溶液鉴别丙烯酸和乳酸
C. 丙烯酸与乳酸都属于有机酸,两者不发生反应
D. 1mol乳酸分别与足量Na、NaOH、NaHCO3反应,消耗三者物质的量之比为2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数,下列叙述正确的是
A. 78 g Na2O2中含有的离子总数为4NA
B. 标准状况下,1.12 L HF中所含的分子总数为0.05 NA
C. 由CO2和O2组成的混合物共有Na个分子,其中的氧原子数为2 NA
D. 0.1 mol L-1 FeCl3溶液中含有的Cl-数目为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、下图是维生素A的分子结构:
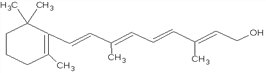
(1)维生素A的分子式是__________________,1mol维生素A最多能与____________mol溴发生加成反应。
(2)根据要求写出下列有机物的结构简式或者系统命名:
CH3CH(CH3)C(CH3)2CH2CH3 :__________________________________.
2﹣甲基﹣2﹣丁烯:________________________________________________.
Ⅱ、人们对苯及芳香烃的认识有一个不断深化的过程。
(3)已知分子式为C6H6的结构有多种,其中的两种见图(Ⅰ)、(Ⅱ):
![]()
①这两种结构的区别表现在:
定性方面(即化学性质方面):Ⅰ不能_______(填字母,下同)而Ⅱ不能________.
A.被酸性高锰酸钾溶液氧化 B.与溴的四氯化碳溶液发生加成反应
C.与溴在催化剂作用下发生取代反应 D.与氢气发生加成反应
定量方面:1molC6H6与H2加成时:Ⅰ需________mol,而Ⅱ需_______mol.
②今发现C6H6还有另一种如图立体结构![]() :该结构的二氯代物有________种.
:该结构的二氯代物有________种.
③根据苯的分子结构,可以推测苯的性质比较稳定,容易发生取代反应,不易发生加成和氧化反应。写出苯与硝酸在催化剂作用下反应的化学方程式____________________________
(4)已知萘的结构简式为 ![]() ,下列关于萘的说法正确的是_______(填编号)
,下列关于萘的说法正确的是_______(填编号)
A.萘的分子式为C10H10 B.1mol萘能与6molH2发生加成反应
C.萘分子中所有原子在同一平面上 D.一溴代萘只有两种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子能在溶液中大量共存的是( )
A. Na+、Mg2+、Cl-、NO3- B. SO42-、Fe2+、K+、OH-
C. Ba2+、Cu2+、SO42-、Cl- D. HCO3-、CO32-、K+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计实验制备乙酸乙酯(如图1):
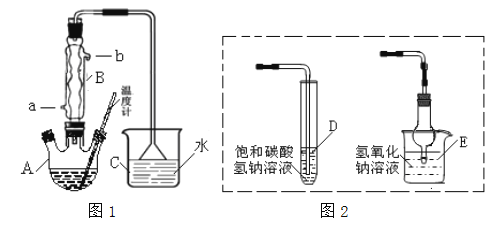
(1)实验时向仪器A中加几块碎石片,其作用是________。 仪器B为冷凝管,冷却水由 ________ (填“a”或“b”)进。
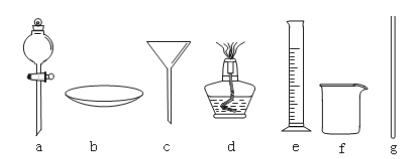
(2)图1方案有明显缺陷,请提出改进建议______________________________。分离乙酸乙酯的操作需要用图3仪器有________(填代号)。
(3)①能否用图2的D装置替代图1的装置C___(填:能或否)。
②能否用图2的E装置替代图1的C装置________ (填:能或否)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com