
| A. | 重大节日期间燃放的焰火的颜色是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 小苏打是制作馒头和面包等糕点的膨松剂,也是治疗胃酸过多的一种药剂 | |
| C. | 为防止月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 大力实施矿物燃料的脱硫脱硝技术,可以减少SO2、NO2的排放 |
分析 A.某些金属元素灼烧有焰色反应;
B.小苏打为碳酸氢钠,加热易分解,可与盐酸反应;
C.生石灰或硅胶可作干燥剂,均无还原性;
D.N、S的氧化物可导致酸雨发生.
解答 解:A.某些金属元素灼烧有焰色反应,则重大节日期间燃放的焰火的颜色是某些金属元素焰色反应所呈现出来的色彩,故A正确;
B.小苏打为碳酸氢钠,加热易分解,可与盐酸反应,则小苏打是制作馒头和面包等糕点的膨松剂,也是治疗胃酸过多的一种药剂,故B正确;
C.生石灰或硅胶可作干燥剂,均无还原性,则为防止月饼等富脂食品因被氧化而变质,常在包装袋中放入铁粉,故C错误;
D.N、S的氧化物可导致酸雨发生,则大力实施矿物燃料的脱硫脱硝技术,可以减少SO2、NO2的排放,故D正确;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:填空题
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠原子的结构示意图: | |
| B. | 过氧化钠的电子式: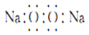 | |
| C. | 小苏打在水中的电离方程式:NaHCO3═Na++HCO3- | |
| D. | 硫化钠的水溶液呈碱性的原因:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下,能够大量共存的一组离子是( )
某温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下,能够大量共存的一组离子是( )| A. | a点对应的溶液:Na+、K+、SO42-、Cl- | |
| B. | b点对应的溶液:I-、Mg2+、K+、ClO- | |
| C. | c点对应的溶液:Na+、S2-、F-、NH4+ | |
| D. | a点对应的溶液:CO32-、Cl-、Al3+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在海轮船壳上镶入锌块保护海轮,利用的是牺牲阳极的阴极保护法 | |
| B. | KNO3溶液和CH3OONH4溶液均显中性.两溶液中水的电离程度相等 | |
| C. | 若1 molNa2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023 | |
| D. | 用pH 均为2 的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
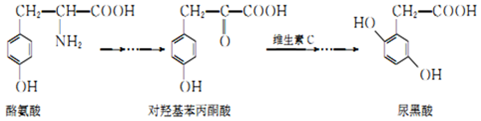
| A. | 酪氨酸既能与盐酸反应,又能与NaOH溶液反应 | |
| B. | 1mol尿黑酸与足量浓溴水反应,最多消耗3molBr2 | |
| C. | 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个 | |
| D. | 对羟基苯丙酮酸分子核磁共振氢谱有4个峰,有1个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
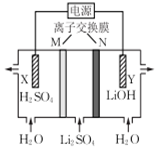
| A. | X电极连接电源负极 | |
| B. | N为阳离子交换膜 | |
| C. | Y电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 制备2.4 g LiOH产生的H2在标准状况下为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
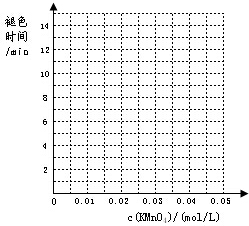 草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
| 实验组别 | c(H2C2O4) /(mol/L) | V(H2C2O4) /ml | c(KMnO4) /(mol/L) | V(KMnO4) /ml | c(H2SO4) /(mol/L) | 褪色所需时间 | 实验 目的 |
| 1 | 0.2 | 2 | 0.0025 | 4 | 0.12 | 6′55″ | (a)探究KMnO4溶液浓度对化学反应速率的影响 |
| 0.2 | 2 | 0.005 | 4 | 0.12 | 5′17″ | ||
| 0.2 | 2 | 0.01 | 4 | 0.12 | 3′20″ | ||
| 0.2 | 2 | 0.02 | 4 | 0.12 | 9′05″ | ||
| 0.2 | 2 | 0.03 | 4 | 0.12 | 11′33″ | ||
| 0.2 | 2 | 0.04 | 4 | 0.12 | 14′20″ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 增加反应物的浓度平衡向正向移动,平衡常数增加 | |
| C. | 升高温度,反应速率加快,反应放出的热量不变 | |
| D. | 改变压强,平衡不发生移动,反应放出的热量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com