
| A. | 次氯酸钙的化学式:CaClO | |
| B. | 氟离子结构示意图: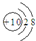 | |
| C. | 质量数为127的钡原子:127Ba | |
| D. | 硫酸的电离方程式:H2SO4═2H+SO${\;}_{4}^{2-}$ |
分析 A.次氯酸钙中阳离子与阴离子个数比为1:2;
B.氟离子的核电荷数为9,核外电子总数为10;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.硫酸为强电解质,在溶液中完全电离出氢离子和硫酸根离子.
解答 解:A.漂白粉有效成分为次氯酸钙,其正确的化学式为:Ca(ClO)2,故A错误;
B.氟离子的核电荷数为9,氟离子正确的结构示意图为: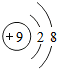 ,故B错误;
,故B错误;
C.钡元素的质子数为56,质量数为127的钡原子可以表示为:56127Ba,故C错误;
D.硫酸为强电解质,硫酸的电离方程式为:H2SO4=2H++SO42-,故D正确;
故选D.
点评 本题考查化学用语的表示方法,为高频考点,题目难度中等,试题基础性强,涉及化学式、离子结构示意图、电离方程式及原子表示方法等,注意掌握常见化学用语的概念及书写原则,试题侧重考查学生的规范答题能力.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:选择题
| A. | Li-Al在电池中作为负极材料,电极反应式:Li-e-=Li+ | |
| B. | 该电池的电池反应式为:2Li+FeS=Li2S+Fe | |
| C. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS | |
| D. | 放电时,Li+向正极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③④ | B. | 只有①②③④⑤ | C. | 只有②③④ | D. | 只有①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:
在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 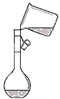 是向容量瓶转移溶液 | |
| B. |  制取氢氧化亚铁 | |
| C. | 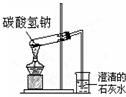 是碳酸氢钠受热分解 | |
| D. | 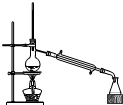 分离四氯化碳(沸点76.75℃)和甲苯(沸点为110.6℃)的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | NaCl | C. | NH3•H2O | D. | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
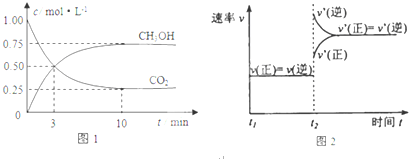
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖注射液不能产生丁达尔现象,所以它不属于胶体 | |
| B. | 盐卤可用于制豆腐 | |
| C. | 明矾可用于水的消毒、杀菌 | |
| D. | 碳酸氢钠能用于治疗胃酸过多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com